使用石油熱裂解的副產物CH
4來制取CO和H
2,其生產流程如圖1:
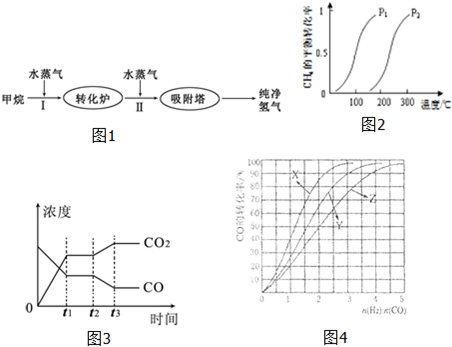
(1)此流程的第Ⅰ步反應為:CH
4(g)+H
2O(g)?CO(g)+3H
2(g),一定條件下CH
4的平衡轉化率與溫度、壓強的關系如圖2.則P
1P
2.(填“<”、“>”或“=”)100℃時,將1mol CH
4和2mol H
2O通入容積為100L的恒容密閉容器中,達到平衡時CH
4的轉化率為0.5.此時該反應的平衡常數K=
.
(2)此流程的第Ⅱ步反應的平衡常數隨溫度的變化如表:
從表中可以推斷:該反應是
反應(填“吸熱”或“放熱”),若在500℃時進行,設起始時CO和H
2O的起始濃度均為0.020mol/L,在該條件下,反應達到平衡時,CO的轉化率為
.如圖3表示該反應在t
1時刻達到平衡、在t
2時刻因改變某個條件引起濃度變化的情況:圖中t
2時刻發生改變的條件是
(寫出一種).
(3)工業上常利用反應Ⅰ產生的CO和H
2合成可再生能源甲醇.
①已知CO(g)、CH
3OH(l)的燃燒熱分別為283.0kJ?mol
-1和726.5kJ?mol
-1,則CH
3OH(l)不完全燃燒生成CO(g)和H
2O(l)的熱化學方程式為
.
②合成甲醇的方程式為:CO(g)+2H
2(g)?CH
3OH(g)△H<0.在230°C?270℃最為有利.為研究合成氣最合適的起始組成比n(H
2):n(CO),分別在230℃、250℃和270℃進行實驗,結果如圖4所示.其中270℃的實驗結果所對應的曲線是
(填字母);當曲線X、Y、Z對應的投料比達到相同的CO平衡轉化率時,對應的反應溫度與投較比的關系是
.
③當投料比為1:1,溫度為230℃,平衡混合氣體中,CH
3OH的物質的量分數為
(保留1位小數).




 應用題作業本系列答案
應用題作業本系列答案
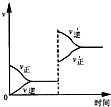 若平衡體系A+B═C+D,增大壓強時反應速率變化如圖所示.則下列關于各物質狀態的說法正確的是( )
若平衡體系A+B═C+D,增大壓強時反應速率變化如圖所示.則下列關于各物質狀態的說法正確的是( )