
分析 (1)發生反應為:Zn+2HCl═ZnCl2+H2↑、Fe+2HCl═FeCl2+H2↑,根據n=$\frac{V}{{V}_{m}}$計算出生成氫氣的物質的量,然后利用質量守恒定律可計算出消耗HCl的物質的量,最后根據V=$\frac{n}{c}$計算出消耗鹽酸的體積;
(2)設出混合物中鋅、鐵的物質的量,分別根據金屬總質量、生成氫氣的物質的量列式計算.
解答 解:(1)標準狀況下4.48L氫氣的物質的量為:$\frac{4.48L}{22.4L/mol}$=0.2mol,根據反應Zn+2HCl═ZnCl2+H2↑、Fe+2HCl═FeCl2+H2↑可知,消耗HCl的物質的量為:n(HCl)=2n(H2)=0.2mol×2=0.4mol,
所以該反應中消耗鹽酸的體積為:$\frac{0.4mol}{2mol/L}$=0.2L=200mL,
答:反應中消耗鹽酸的體積為200mL或0.2L;
(2)設Zn、Fe的物質的量分別為x、y
由Zn+2HCl═ZnCl2+H2↑、Fe+2HCl═FeCl2+H2↑可知關系式:Zn~2HCl、Fe~2HCl,
則:$\left\{\begin{array}{l}{65x+56y=12.1}\\{x+y=0.2}\end{array}\right.$,解得:x=0.1mol、y=0.1mol,
答:該混合物中鋅、鐵的物質的量都為0.01mol.
點評 本題考查混合物反應的計算,題目難度中等,明確金屬與酸反應的化學方程式是解答的關鍵,并學會利用質量關系、消耗的酸來列式計算即可解答,試題培養了學生的化學計算能力.


科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液與足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 硫化鈉的水解反應:S2-+H3O+HS-+H2O | |
| D. | 將0.2 mol•L-1的NH4Al(SO4)2溶液與0.3 mol•L-1的Ba(OH)2溶液等體積混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 此合金的熔點、硬度比鎂和鋁的熔點、硬度都高 | |
| B. | 此合金能全部溶解于稀鹽酸中 | |
| C. | 此合金能全部溶解于氫氧化鈉溶液中 | |
| D. | 比合金不能全部溶解于過量Fe2Cl3溶液中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ⅠA族和ⅥA族元素形成的原子個數比為1:1、電子總數為38的化合物,是含共價鍵的離子化合物 | |
| B. | 在SiO2晶體中,1個硅原子和2個氧原子形成2個共價鍵 | |
| C. | HI的相對分子質量比HF大,所以HI的沸點比HF高 | |
| D. | H與D、16O與18O互為同位素;H216O、D216O、H218O、D216O互為同素異形體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
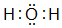 .
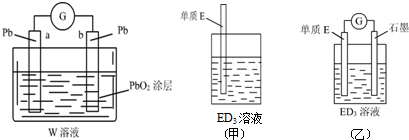
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2使酸性KMnO4褪色:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ | |
| B. | Fe(OH)2與HNO3溶液的反應:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 足量NaOH與磷酸二氫銨反應:OH-+NH4+=NH3•H2O | |
| D. | 將SO2通入BaCl2溶液中:SO2+H2O+Ba2+=BaSO3↓+2H+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com