
| A. | 向蛋白質溶液中加入CuSO4溶液,蛋白質發生變性 | |
| B. | 一定條件下,乙醇能被氧化成一種刺激性氣味的液體 | |
| C. | 用Cl2和NaOH溶液為原料制備次氯酸鈉 | |
| D. | 海水提溴和生產玻璃過程中均涉及氧化還原反應 |
分析 A.蛋白質遇重金屬鹽發生變性;
B.乙醇能被氧化成乙醛;
C.氯氣跟氫氧化鈉溶液反應:Cl2+2NaOH=NaClO+NaCl+H2O;
D.制造普通玻璃的反應類型主要是復分解反應.
解答 解:A.硫酸銅是重金屬鹽,蛋白質遇重金屬鹽發生變性,故A正確;
B.乙醇能被氧化成乙醛,乙醛有刺激性氣味,故B正確;
C.氯氣跟氫氧化鈉溶液反應:Cl2+2NaOH=NaClO+NaCl+H2O,可制得次氯酸鈉,故C正確;
D.制造普通玻璃的反應類型主要是復分解反應,不涉及氧化還原反應,故D錯誤.
故選D.
點評 本題考查氧化還原反應以及物質性質的考查,題目難度不大,本題注意常見工業生產原理,注重基礎知識的積累.


科目:高中化學 來源: 題型:選擇題
| A. | 配制0.1mol•L-1莫爾鹽溶液500mL,需莫爾鹽19.6克 | |
| B. | 可與含Fe2+、HClO、H+、Cl-微粒的溶液大量共存 | |
| C. | 加入過量Ba(OH)2溶液發生反應:2Ba2++2SO42-+Fe2++2OH-=2BaSO4↓+Fe(OH)2↓ | |
| D. | 取樣,加入濃NaOH溶液并加熱,出現可讓藍色石蕊試紙變紅的氣體,證明含NH4+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯的結構簡式:CH2CH2 | |
| B. | 碳正離子 中質子數與電子數之比值為3:2 中質子數與電子數之比值為3:2 | |
| C. | 水合氫離子的結構式為 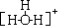 | |
| D. | NaHCO3水解反應的離子方程式:HCO3-+H2O?H3O++CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 的同分異構體的結構簡式:
的同分異構體的結構簡式: .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
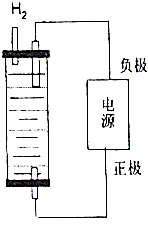 制取漂白粉的氯氣通過電解飽和食鹽水得到.
制取漂白粉的氯氣通過電解飽和食鹽水得到.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
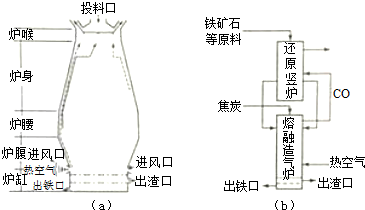
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com