
| A. | 滴加KI-淀粉溶液變為藍色 | |
| B. | 該溶液中Cu2+、NH4+、SO4-、Cl- 可以大量共存 | |
| C. | 與硝酸酸化的AgNO3溶液反應有沉淀生成并放出氣體 | |
| D. | 配制該溶液時,將FeBr2粉末溶解在HBr溶液中,并加入少量鐵釘 |
分析 A.KI與FeBr2不反應不能生成碘單質;
B.離子之間不反應,且與FeBr2不反應;
C.亞鐵離子與硝酸發生氧化還原反應生成NO,溴離子與銀離子反應生成AgBr;
D.FeBr2粉末溶解后溶液中溴化亞鐵水解變渾濁,需要加入對應酸抑制水解,亞鐵離子被空氣中氧氣氧化,加入鐵粉防止亞鐵離子被氧化.
解答 解:A.KI與FeBr2不反應,則滴加KI-淀粉溶液無現象,故A錯誤;
B.離子之間不反應,且與FeBr2不反應,則離子之間可大量共存,該溶液中Cu2+、NH4+、SO4-、Cl- 可以大量共存,故B正確;
C.亞鐵離子與硝酸發生氧化還原反應生成NO,溴離子與銀離子反應生成AgBr沉淀,則反應有沉淀生成并放出氣體,故C正確;
D.配制該溶液時,將FeBr2粉末溶解在HBr溶液中防止水解,并加入少量鐵釘防止亞鐵離子被氧化,故D正確;
故選A.
點評 本題考查離子的共存,為高頻考點,把握習題中的信息及常見離子之間的反應為解答的關鍵,側重復分解反應、氧化還原反應的離子共存考查,題目難度中等.


科目:高中化學 來源: 題型:解答題
| 裝置 | 現象 | 結論及解釋 |
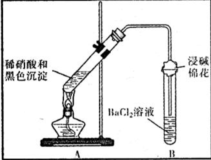 | ①A試管中黑色沉淀逐漸溶解 ②A試管上方出現紅棕色氣體 ③B試管中出現白色沉淀 | a.現象②說明褐色沉淀具有 還原性性. b.試管B中產生白色沉淀的總反應的離子方程式為 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
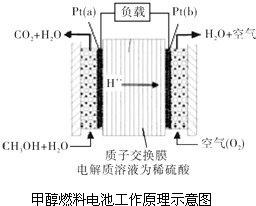 科學家預言,燃料電池將是21世紀獲得電能的重要途徑.近幾年開發的甲醇燃料電池是采用鉑作電極催化劑,電池中的質子交換膜只允許質子和水分子通過.其工作原理的示意圖如圖所示:
科學家預言,燃料電池將是21世紀獲得電能的重要途徑.近幾年開發的甲醇燃料電池是采用鉑作電極催化劑,電池中的質子交換膜只允許質子和水分子通過.其工作原理的示意圖如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使它轉化為較穩定物質,便于保存和運輸 | |
| B. | 增強漂白和消毒作用 | |
| C. | 使轉化為較易溶于水的物質 | |
| D. | 增加氯的質量分數,有利于漂白、消毒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲烷的標準燃燒熱為-890.3 kJ•mol-1,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,將0.5 molN2和1.5 mol H2置于密閉容器中充分反應生成NH3(g),放熱19.3 kJ,其熱化學方程式為:N2(g)+3H2(g)$?_{500℃、30Mpa}^{催化劑}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反應的中和熱△H=-57.3 kJ•mol-1,則H2SO4和Ca(OH)2反應的中和熱△H=2×(-57.3)kJ•mol-1 | |
| D. | 碳酸氫鈉溶液中加入過量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
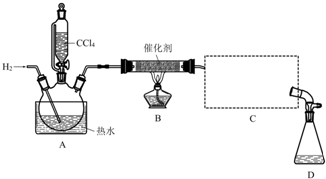
| 物質 | 相對分子質量 | 密度/(g•mL-1) | 沸點/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 難溶 |
| CCl4 | 154 | 1.59 | 76.7 | 難溶 |
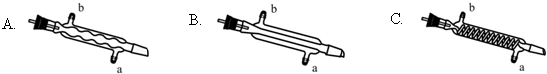
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鄰-二溴苯只有一種 | |
| B. | 苯分子中所有原子在同一平面上 | |
| C. | 二甲苯沒有同分異構體 | |
| D. | 苯既能發生加成反應也能發生取代反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 維生素C不具有還原性 | |
| B. | 上述過程中砷元素發生還原反應 | |
| C. | 上述過程中+5價砷類物質作還原劑 | |
| D. | 1 mol+5價砷完全轉化為+3價砷,共失去2 mol電子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com