
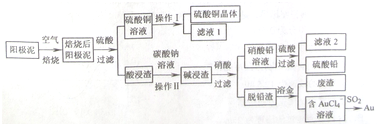
分析 粗銅精煉后的陽極泥含有Cu、Au(金)和PbSO4等雜質,焙燒后金屬銅成為氧化銅,酸浸可以得到硫酸銅溶液,硫酸銅溶液經過蒸發濃縮,降溫結晶,過濾、洗滌,干燥獲得硫酸銅晶體;Au(金)和PbSO4等雜質經碳酸鈉浸洗、濃硝酸氧化后,過濾得到硝酸鉛溶液,濾液加硫酸生成硫酸鉛沉淀,再過濾得到硫酸鉛;脫鉛濾渣主要是金,加王水溶金,得到含有AuCl4-的溶液,AuCl4-可以被SO2還原得到Au.
(1)電解精煉粗銅時一般用硫酸銅溶液作電解質溶液,粗銅中的銅和鉛會發生失電子的氧化反應,據此回答;
(2)陽極泥的成分為Cu、Au(金)和PbSO4 等,在焙燒過程中銅被氧化為了CuO,根據陽極泥充分的粉碎,增大接觸面積可以提高焙燒效率來回答;
(3)操作I的步驟是從硫酸銅溶液中獲得硫酸銅晶體,操作II是從酸浸渣(PbSO4)中得到堿浸渣(PbCO3),據此回答;
(4)SO2還原AuCl4-反應得到氧化產物是SO42-,還原產物是Au,配平書寫方程式;
(5)將濾液1并入硫酸銅溶液進行循環操作,有利于充分利用,據此回答;
(6)碳酸鉛比硫酸鉛更加難溶,往硫酸鉛中加入碳酸鈉,發生的是沉淀溶解轉化的反應.
解答 解:粗銅精煉后的陽極泥含有Cu、Au(金)和PbSO4等雜質,焙燒后金屬銅成為氧化銅,酸浸可以得到硫酸銅溶液,硫酸銅溶液經過蒸發濃縮,降溫結晶,過濾、洗滌,干燥獲得硫酸銅晶體;Au(金)和PbSO4等雜質經碳酸鈉浸洗、濃硝酸氧化后,過濾得到硝酸鉛溶液,濾液加硫酸生成硫酸鉛沉淀,再過濾得到硫酸鉛;脫鉛濾渣主要是金,加王水溶金,得到含有AuCl4-的溶液,AuCl4-可以被SO2還原得到Au.
(1)電解精煉粗銅時一般用硫酸銅溶液作電解質溶液;電解精煉的粗銅作陽極會發生氧化反應,其中單質銅和活潑性比Cu強的金屬都會發生溶解,因此粗銅中的銅和鉛會發生失電子的氧化反應,電極反應式為:Pb-2e-+SO42-=PbSO4,
故答案為:CuSO4;Pb-2e-+SO42-=PbSO4;
(2)由題干可知,用于焙燒的陽極泥的成分為Cu、Au(金)和PbSO4 等,所以在焙燒過程中銅被氧化為了CuO,而Au(金)和PbSO4 均較穩定,要使焙燒效率提高,合理措施是把得到的陽極泥充分的粉碎,增大接觸面積,或把反應后的氣體在次逆流焙燒,這樣可以升高溫度且減少能耗,
故答案為:將陽極泥粉碎,逆流焙燒等; CuO;
(3)操作I的步驟是從硫酸銅溶液中獲得硫酸銅晶體,因此該步驟是蒸發濃縮、冷卻結晶、過濾、洗滌、干燥等步驟,操作II是從酸浸渣(PbSO4)中得到堿浸渣(PbCO3),因此該操作是過濾操作.
故答案為:蒸發濃縮,降溫結晶;
(4)SO2還原AuCl4-中還原劑和氧化劑都比較明確,因此很容易推測出氧化產物是SO42-,還原產物是Au,根據氧化還原反應得失電子守恒先缺項配平,然后根據電荷守恒再配平,因此得到的反應方程式為:2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+;
故答案為:2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+;
(5)濾液1是在結晶硫酸銅時剩下的濾液,還含有少量的未析出的硫酸銅,因此并入前面的硫酸銅溶液進行循環,有利于充分利用,因此類似此處的做法,應該是流程中得到的另一濾液2,此濾液2是在硝酸鉛溶液中加入硫酸生成硫酸鉛沉淀并過濾走硫酸鉛后剩下的溶液,此溶液中H+沒有發生反應,因此還有大量的硝酸溶液,所以可以把此濾液當成硝酸加入前面的堿浸渣中溶解堿浸渣;
故答案為:用濾液2溶解堿浸渣;
(6)通過比較兩種沉淀的溶度積,可以看出碳酸鉛比硫酸鉛更加難溶,因此往硫酸鉛中加入碳酸鈉,發生的是沉淀溶解轉化的反應,離子方程式要注意標明狀態,方程式為:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).
故答案為:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).
點評 本題主要考查了物質的分離、離子的檢驗、電解原理的應用、沉淀的轉化等知識,側重于考查學生對基礎知識的綜合應用能力,是一道能力提升題,題目難度較大.


 七星圖書口算速算天天練系列答案
七星圖書口算速算天天練系列答案 初中學業考試導與練系列答案
初中學業考試導與練系列答案科目:高中化學 來源: 題型:解答題
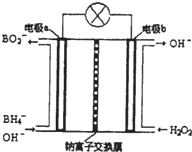 硼氫化鈉(NaBH4)是有機合成中的重要還原劑,最新研究發現,以NaBH4和H2O2為原料,NaOH溶液作電解質溶液,可以設計成全液流電池,其工作原理如圖所示,假設電池工作前左右兩槽溶液的體積各為1L,回答下列問題:
硼氫化鈉(NaBH4)是有機合成中的重要還原劑,最新研究發現,以NaBH4和H2O2為原料,NaOH溶液作電解質溶液,可以設計成全液流電池,其工作原理如圖所示,假設電池工作前左右兩槽溶液的體積各為1L,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①與② | B. | ①與③ | C. | ②與③ | D. | ②與④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃氨水 | B. | NaOH | C. | Ba(OH)2 | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-485KJ/mol | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+485KJ/mol | ||
| C. | 2 H2(g)+O2(g)═2 H2O(g)△H=+485KJ/mol | D. | 2 H2(g)+O2(g)═2 H2O(g)△H=-485KJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 第3周期金屬元素最高價氧化物對應的水化物,其堿性隨原子序數的增大而減弱 | |
| B. | 砹(At)是第ⅦA族元素,其氫化物的穩定性大于HCl | |
| C. | 第2周期非金屬元素的氣態氫化物溶于水后,水溶液均為酸性 | |
| D. | 鉈(Tl)與鋁同主族,其單質既能與鹽酸反應,又能與氫氧化鈉溶液反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com