
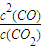 ;
;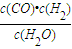 ,反應H2(g)+CO2(g)?CO(g)+H2O(g)的平衡常數為K2=
,反應H2(g)+CO2(g)?CO(g)+H2O(g)的平衡常數為K2=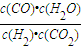 ,由平衡常數
,由平衡常數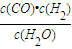 ×
×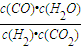 =
=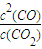 ,即K=K1×K2;
,即K=K1×K2;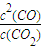 ;K=K1×K2;
;K=K1×K2;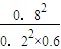 =26.7>19,該反應未達平衡狀態,反應向逆反應進行;
=26.7>19,該反應未達平衡狀態,反應向逆反應進行;

科目:高中化學 來源: 題型:
| c2(CO) |
| c(CO2) |
| c2(CO) |
| c(CO2) |
查看答案和解析>>
科目:高中化學 來源: 題型:
| c2(CO) |
| c(CO2) |
| c2(CO) |
| c(CO2) |
查看答案和解析>>
科目:高中化學 來源:2013屆河南省焦作市分校高二上學期期中考試化學試卷 題型:填空題
(12分)化學平衡原理在工農業生產中發揮著重要的指導作用。
(1)反應C(s)+CO2(g)
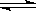 2CO(g)平衡常數K的表達式為
;
2CO(g)平衡常數K的表達式為
;
已知C(s) +
H2O(g)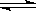 CO(g)+H2(g)的平衡常數為K1;H2(g)+CO2(g)
CO(g)+H2(g)的平衡常數為K1;H2(g)+CO2(g) 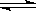 CO(g)+H2O(g)的平衡常數為K2 ,則K與K1、K2二者的關系為
。
CO(g)+H2O(g)的平衡常數為K2 ,則K與K1、K2二者的關系為
。
(2) 已知某溫度下,反應2SO2+O2 2SO3,的平衡常數K=19
2SO3,的平衡常數K=19
在該溫度下的體積固定的密閉容器中充入C(SO2)=1mol·L-1,C(O2)=1 mol·L-1,當反應在該溫度下SO2轉化率為80%時,該反應 (填“是”或“否”)達到化學平衡狀態,若未達到,向 (填“正反應”或“逆反應”) 方向進行。
(3)對于可逆反應:aA(g) +bB(g) cC(g)+dD(g)
△H = a kJ·mol-1;
cC(g)+dD(g)
△H = a kJ·mol-1;
若a+b>c+d,增大壓強平衡向_______(填“正反應”或“逆反應”)方向移動;若升高溫度,平衡向逆反應方向移動,則a_______0(填“>”或“<”)
查看答案和解析>>
科目:高中化學 來源:2012-2013學年甘肅省蘭州一中高二(上)期中化學試卷(理科)(解析版) 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com