
【題目】明礬石經處理后得到明礬(KAl(SO4)2·12H2O)。由明礬制備Al、K2SO4和H2SO4的工藝過程如下所示:
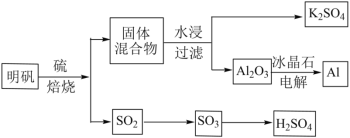
焙燒明礬的化學方程式為:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
請回答下列問題:
(1)在焙燒明礬的反應中,氧化劑和還原劑的物質的量之比為_______。
(2)從水浸后的濾液中得到K2SO4晶體的操作方法是_______。
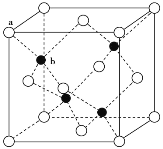
(3)A12O3在一定條件下可制得AIN,AlN的晶體結構與金剛石相似,晶胞結構如圖所示。每個晶胞中含有_______個鋁原子,若Al與N原子最近距離為apm,則該晶體的密度為_______g/cm3。(阿伏加德羅常數用NA表示)
(4)SO2分子的空間構型為_______
(5)焙燒產生的SO2可用于制硫酸。已知25℃、101kPa時
2SO2(g)+O2(g)![]() 2SO3(g)△H1=一197kJ/mol;
2SO3(g)△H1=一197kJ/mol;
2H2O(g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol。
則SO3(g)與H2O(l)反應的熱化學方程式是_______。
【答案】1:1 蒸發濃縮,冷卻結晶 4 ![]() V形或角形 SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ·mol-1
V形或角形 SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ·mol-1
【解析】
(1)根據焙燒明礬方程式,判斷出氧化劑和還原劑,即可知道答案;
(2)從溶液中得到固體硫酸鉀,可以才用蒸發結晶的方法;
(3)AlN的晶胞中N原子數目為4,Al原子數目為8×![]() +6×
+6×![]() =4,頂點白色球與相鄰黑色距離為晶胞體對角線的
=4,頂點白色球與相鄰黑色距離為晶胞體對角線的![]() ,則晶胞體對角線長為4apm,晶胞棱長為
,則晶胞體對角線長為4apm,晶胞棱長為![]() pm,晶胞的體積為(
pm,晶胞的體積為(![]() pm)3,1mol晶胞的質量為4×41g,得其密度;
pm)3,1mol晶胞的質量為4×41g,得其密度;
(4) SO2分子中S原子價層電子對數=2+![]() =3,且含有1個孤電子對,根據價電子對互斥理論判斷S原子的軌道雜化類型及分子的空間構型;
=3,且含有1個孤電子對,根據價電子對互斥理論判斷S原子的軌道雜化類型及分子的空間構型;
(5) ①2SO2(g)+O2(g)2SO3(g)△H1=-197kJ/mol,②2H2O(g)=2H2O(1)△H2=-44kJ/mol,③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ/mol,依據蓋斯定律③-①-②得到。
(1)4KAl(SO4)212H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反應硫單質中硫元素化合價升高為+4價。硫酸根離子中硫元素化合價從+6價變化為+4價,故還原劑是硫單質,而氧化劑是6mol的硫酸根離子,即3mol的4KAl(SO4)212H2O,氧化劑和還原劑的物質的量之比1:1,故答案為1:1;
(2)從溶液中得到固體硫酸鉀,可以才用蒸發結晶的方法,故答案:蒸發濃縮,冷卻結晶;
(3)AlN的晶胞中N原子數目為4,Al原子數目為8×![]() +6×
+6×![]() =4,頂點白色球與相鄰黑色距離為晶胞體對角線的
=4,頂點白色球與相鄰黑色距離為晶胞體對角線的![]() ,則晶胞體對角線長為4apm,晶胞棱長為
,則晶胞體對角線長為4apm,晶胞棱長為![]() pm,晶胞的體積為(
pm,晶胞的體積為(![]() pm)3,1mol晶胞的質量為4×41g,得其密度
pm)3,1mol晶胞的質量為4×41g,得其密度![]() g/cm3,故答案為:4;
g/cm3,故答案為:4;![]() ;
;
(4)SO2分子中S原子價層電子對數=2+![]() =3,且含有1個孤電子對,根據價電子對互斥理論判斷S原子的軌道雜化類型為sp2,分子的空間構型為V形,故答案為:V形或角形;
=3,且含有1個孤電子對,根據價電子對互斥理論判斷S原子的軌道雜化類型為sp2,分子的空間構型為V形,故答案為:V形或角形;
(5)①2SO2(g)+O2(g)2SO3(g)△H1=-197kJ/mol,②2H2O(g)=2H2O(1)△H2=-44kJ/mol,③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ/mol,依據蓋斯定律③-①-②得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-304 kJ/mol,即反應的熱化學方程式為:SO3(g)+H2O(l)=H2SO4(l)△H=-152 kJ/mol;故答案為:SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ/mol。


科目:高中化學 來源: 題型:
【題目】原子序數依次增加的X、Y、Z、W四種元素原子序數均小于36,Y基態原子最外層電子數是其內層電子總數的3倍,X、W基態原子是同周期元素中未成對電子數最多的原子,X與Z的原子核內質子數之和等于W原子核內質子數,Z基態原子只有1個未成對的電子。回答下列問題:
(1)已知化合物XZ3與H2Y(Y的氫化物)發生反應的化學方程式為XZ3+H2Y→XH3+HZY,則元素的電負性:Y______Z(填“大于”或“小于”),化合物HZY分子的空間構型為______。
(2)X的一種氫化物的相對分子質量為32,1mol該氫化物中的σ鍵數是______。
(3)①元素Y的一種單質分子與元素X、Y形成的一種離子互為等電子體,這兩種微粒的化學式是_______、________。
②基態W原子的電子排布式是_______________。
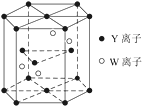
(4)元素Y和W的一種化合物的晶體結構如圖所示,該晶體的化學式為______;金屬原子______(選填“鉀”、“鎂”、“銅”)形成的晶體的堆積方式,與上述晶胞中Y離子的堆積方式相同。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.0.1molNa2O2中陰離子的數目為0.2NA
B.1L0.1mol/L的HF溶液中F-數目為0.1NA
C.0.1molFe在點燃條件下與氧氣反應時轉移電子數目為0.3NA
D.0.4mol濃鹽酸與足量的MnO2加熱充分反應,產生Cl2的數目小于0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】飽和一元醇35.2g和足量的金屬Na反應,生成標準狀況下氫氣為4.48L,該醇可氧化成醛,則其結構可能有幾種( )
A.2種B.3種C.4種D.5種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列關于NaOH溶液和氨水的說法正確的是( )
A.25℃時,將pH=9的NaOH溶液與pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,則NaOH溶液與H2SO4溶液的體積比為20:1
B.pH=13的兩溶液稀釋100倍,pH都為11
C.兩溶液中分別加入少量NH4Cl固體,c(OH )均減小
D.體積相同、pH相同的兩溶液能中和等物質的量的鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫疊氮酸(HN3)和莫爾鹽[(NH4)2SO4·FeSO4·6H2O]是兩種常用原料。
(1)氫疊氮酸易溶于水,25℃時,該酸的電離常數為Ka=10×10-5。
①氫疊氮酸在水溶液中的電離方程式為_______
②0.2mol/L的HN3溶液與0.1mol/L的NaOH溶液等體積混合后,恢復到25℃,此時,溶液呈酸性,則混合溶液中各離子和HN3分子濃度由大到小的順序為_______。
(2)在FeSO4溶液中,加入(NH4)2SO4固體可制備莫爾鹽晶體[(NH4)2Fe(SO4)2·6H2O],為了測定產品純度,稱取ag產品溶于水,配制成500mL溶液,用濃度為cmol/L的酸性高錳酸鉀溶液滴定,每次所取待測液體積均為25.00mL,實驗結果記錄如下:(已知莫爾鹽的分子量為392)
實驗次數 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液體積/mL | 25.52 | 25.02 | 24.98 |
①配制莫爾鹽溶液,所使用的玻璃儀器除了燒杯和玻璃棒外還有_______
②滴定終點的現象是_______,通過實驗數據,計算該產品的純度為_______(用含字母a、c的式子表示)。
③上表第一次實驗中記錄數據明顯大于后兩次,其原因可能是_______。
A 第一次滴定時,錐形瓶用待裝液潤洗
B 該酸性高錳酸鉀標準液保存時間過長,部分變質
C 滴定前酸式滴定管中尖嘴處有氣泡,滴定結束后氣泡消失
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗裝置進行的相應實驗,能達到實驗目的的是( )
A.除去Cl2中含有的少量HCl 
B.蒸干FeCl3飽和溶液制備FeCl3晶體
C.制取少量純凈的CO2氣體
D.分離CCl4萃取碘水后已分層的有機層和水層
查看答案和解析>>
科目:高中化學 來源: 題型:
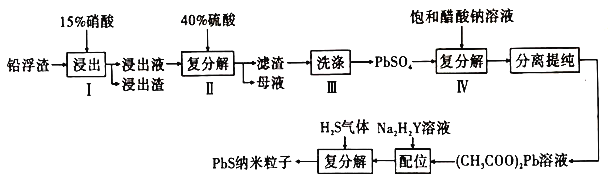
【題目】鉛及其化合物用廣泛,請回答下列相關問題:
(1)鉛是碳的同族元素,比碳多4個電子層。鉛元素的原子結構示意圖為____________;相同溫度下,同濃度的![]() 溶液和
溶液和![]() 溶液中水的電離程度___________(填“前者大”“后者大”或“一樣大”)。
溶液中水的電離程度___________(填“前者大”“后者大”或“一樣大”)。
(2)工業上利用鋅冶煉過程中的鉛浮渣(主要成分是![]() 、
、![]() ,含有少量
,含有少量![]() 、
、![]() 和其他不溶于硝酸的雜質)生產硫酸鉛和硫化鉛納米粒子,流程如圖所示:
和其他不溶于硝酸的雜質)生產硫酸鉛和硫化鉛納米粒子,流程如圖所示:
已知:a.25℃時,![]() ,
,![]() ,
,![]() 。
。
b.![]() 二鈉簡寫成
二鈉簡寫成![]() ,可以與
,可以與![]() 及其他許多金屬離子形成穩定的配離子。
及其他許多金屬離子形成穩定的配離子。
①已知步驟Ⅰ有![]() 產生,
產生,![]() 被足量稀硝酸氧化成
被足量稀硝酸氧化成![]() 。寫出
。寫出![]() 參加反應的離子方程式:________。
參加反應的離子方程式:________。
②步驟Ⅰ需控制硝酸的用量并使![]() 稍有剩余,原因是_________________________。
稍有剩余,原因是_________________________。
③硫酸鉛微溶于水,醋酸鉛易溶于水,步驟Ⅳ能發生反應的原因是____________________。
④不用硫化氫氣體直接通入![]() 溶液來制備
溶液來制備![]() 納米粒子的原因是__________________。
納米粒子的原因是__________________。
⑤已知鉛蓄電池工作時會產生![]() ,則鉛蓄電池
,則鉛蓄電池![]() 充電時的陽極反應式為________________________________。
充電時的陽極反應式為________________________________。
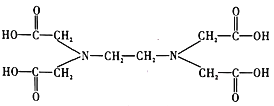
⑥![]() 又名乙二氨四乙酸,是一種弱酸(結構如圖),在水溶液中可形成內鹽(總電荷為0,電中性的化合物,但是帶正電和負電的原子不同)。據此寫出
又名乙二氨四乙酸,是一種弱酸(結構如圖),在水溶液中可形成內鹽(總電荷為0,電中性的化合物,但是帶正電和負電的原子不同)。據此寫出![]() 的結構:_________________。
的結構:_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高純硝酸鍶[Sr(NO3)2]可用于制造信號燈,光學玻璃等。工業級硝酸鍶含硝酸鈣、硝酸鋇等雜質,提純流程如圖:
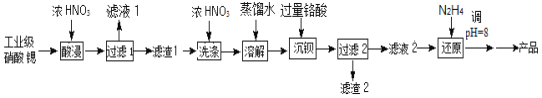
已知:①“濾渣1”的成份為Ba(NO3)2、Sr(NO3)2;②鉻酸(H2CrO4)為二元弱酸
(1)用鉻酸(H2CrO4)“沉鋇”,是工業上常用的方法。H2CrO4中Cr元素的化合價為__,其在水中的電離方程式為___。
(2)“酸浸”不能采用高溫的原因是__,“濾液1”的主要溶質是__(寫化學式)。
(3)相對于水洗,用濃HNO3洗滌的優點是__。
(4)“濾液2”中過量的H2CrO4被N2H4還原為Cr3+,同時放出無污染的氣體,寫出發生反應的離子方程式__。
(5)已知Cr(OH)3類似氫氧化鋁,還原后溶液的pH不能大于8的原因是(用離子方程式說明理由)__。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com