
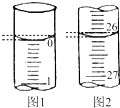
 某學生用已知物質的量濃度的鹽酸來測定未知物質的量濃度的氫氧化鈉溶液(盛放于錐形瓶中)時,選擇酚酞作指示劑,請填寫下列空白:
某學生用已知物質的量濃度的鹽酸來測定未知物質的量濃度的氫氧化鈉溶液(盛放于錐形瓶中)時,選擇酚酞作指示劑,請填寫下列空白:| 滴定次數 | 0.1000mol-L-1鹽酸的體積/mL | ||
| 滴定前 | 滴定后 | 體積/mL | |
| 1 | 0.10 | 26.21 | 26.11 |
| 2 | 1.56 | 31.30 | 29.74 |
| 3 | 0.22 | 26.31 | 26.09 |
分析 (1)根據滴定終點溶液顏色發生變化,且且半分鐘內不復原;根據滴定管的結構和精確度以及測量的原理;
(2)先判斷數據的合理性,然后鹽酸溶液的平均體積,然后根據HCl~NaOH求氫氧化鈉的物質的量濃度;
(3)根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析不當操作對V(標準)的影響,以此判斷濃度的誤差;
解答 解:(1)滴定前溶液呈堿性,溶液為紅色,滴定終點時溶液為無色,滴定終點時溶液顏色由紅色突變為無色,且半分鐘內不褪色;起始讀數為0.00mL,終點讀數為26.10mL,鹽酸溶液的體積為26.10mL;
故答案為:溶液顏色由紅色變為無色,且半分鐘內不變色;26.10;
(2)三次消耗的鹽酸的體積為26.11mL,29.74mL,26.09mL,第二組舍去,其他兩次溶液的平均體積為26.10mL,NaOH溶液的體積為25.00mL,
HCl~NaOH
1 1
0.1000mol-L-1×26.10mL C(NaOH)×25.00mL
解得:C(NaOH)=0.1044 mol/L;
故答案為:0.1044mol/L;
(3)A、酸式滴定管未用標準鹽酸溶液潤洗就直接注入標準鹽酸溶液,標準液被稀釋,濃度偏小,造成V(標準)偏大,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,測定c(NaOH)偏大,故A正確;
B、滴定前盛放氫氧化鈉溶液的錐形瓶用蒸餾水洗凈后沒有干燥,待測液的物質的量不變,對V(標準)無影響,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,測定c(NaOH)無影響,故B錯誤;
C、酸式滴定管尖嘴處在滴定前有氣泡,滴定后氣泡消失,造成V(標準)偏大,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,測定c(NaOH)偏大,故C正確;
D、讀取鹽酸體積時,滴定開始時仰視讀數,滴定結束時俯視讀數,造成V(標準)偏小,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,測定c(NaOH)偏低,故D錯誤;
故答案為:AC.
點評 本題主要考查了中和滴定操作、誤差分析以及計算,難度不大,理解中和滴定的原理是解題關鍵.


科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
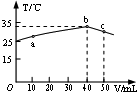
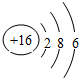
| A. | HA溶液的物質的量濃度為0.01mol/L | |
| B. | a→b的過程中,混合溶液中可能存在:c(A-)=c(Na+) | |
| C. | b→c的過程中,溫度降低的主要原因是溶液中A-發生了水解反應 | |
| D. | 25℃時,HA的電離平衡常數K約為1.25×10-3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
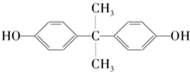 ,生產聚碳酸酯的過程如下:
,生產聚碳酸酯的過程如下: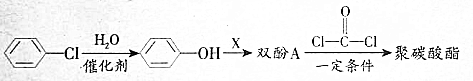
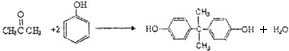 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
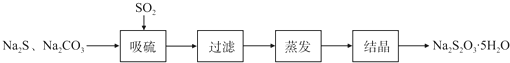
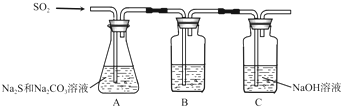
| 序號 | 實驗操作 | 預期現象 | 結論 |
| ① | 取少量樣品于試管中,加入適量蒸餾水,充分振蕩溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振蕩. | 有白色沉淀生成 | 樣品含NaCl |
| ② | 另取少量樣品于燒杯中,加入適量蒸餾水,充分攪拌溶解,另取少量樣品于燒杯中,加入適量蒸餾水,充分攪拌溶解,加入過量CaCl2溶液,攪拌,靜置,用pH計測定上層清液pH | 有白色沉淀生成,上層清液pH大于10.2 | 樣品含NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-2.92kJ/mol | |
| B. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-0.72kJ/mol | |
| C. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-18kJ/mol | |
| D. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-73kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10min內,Y的平均反應速率為0.03 mol•Lˉ1•sˉ1 | |
| B. | 第10min時,X的反應速率為0.01 mol•Lˉ1•minˉ1 | |
| C. | 10min內,消耗0.2 mol X,生成0.4 mol Z | |
| D. | 10min內,X和Y反應放出的熱量為a kJ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com