
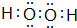 .
.分析 U、W、X、Y、Z都是短周期元素,且原子序數依次增大.W的氣態氫化物甲和W的最高價氧化物對應的水化物可以化合生成鹽,應為銨鹽,則W為N元素、甲為NH3;Y 元素原子的 K 層電子數與M層電子數相同,則M層電子數為2,故Y為Mg;Z元素的單質是太陽能轉換為電能的常用材料,則Z為Si;U與X可形成常溫下呈液態的分子乙,乙為常見的10 電子分子,則U為H元素、X為O元素,乙為H2O,據此解答.
解答 解:U、W、X、Y、Z都是短周期元素,且原子序數依次增大.W的氣態氫化物甲和W的最高價氧化物對應的水化物可以化合生成鹽,應為銨鹽,則W為N元素、甲為NH3;Y 元素原子的 K 層電子數與M層電子數相同,則M層電子數為2,故Y為Mg;Z元素的單質是太陽能轉換為電能的常用材料,則Z為Si;U與X可形成常溫下呈液態的分子乙,乙為常見的10 電子分子,則U為H元素、X為O元素,乙為H2O,
(1)Z為Si,元素在周期表中的位置:第三周期ⅣA族,
故答案為:第三周期ⅣA族;
(2)同周期自左而右原子半徑減小、同主族自上而下原子半徑增大,故原子半徑:O<Si<Mg,
故答案為:O<Si<Mg;
(3)U與X形成的18電子化合物為H2O2,電子式是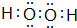 ,
,
故答案為: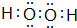 ;
;
(4)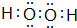 中氧原子之間形成非極性鍵,氧原子與氫原子之間形成極性鍵,
中氧原子之間形成非極性鍵,氧原子與氫原子之間形成極性鍵,
故答案為:bc;
(5)已知:①N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
由蓋斯定律,②×3-①×2得:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=3×(-483.6kJ/mol)-2×(-92.4kJ/mol)=-1266kJ/mol,故反應熱化學方程式為:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266kJ/mol,
故答案為:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266kJ/mol;
(6)以N2、H2為電極反應物,以HCl-NH4Cl溶液為電解質溶液制造新型燃料電池,正極發生還原反應,氮氣在正極失去電子,酸性條件下生成銨根離子,該電池的正極電極反應式:N2+8H++6e-=2NH4+,溶液中H+移向正極,
故答案為:N2+8H++6e-=2NH4+;正.
點評 本題考查結構性質位置關系應用,推斷元素是解題關鍵,(6)中氫離子移動方向判斷為易錯點,學生容易認為正極生成銨根離子,導致氫離子向負極移動,忽略消耗氫離子與生成銨根離子數量關系


科目:高中化學 來源: 題型:解答題
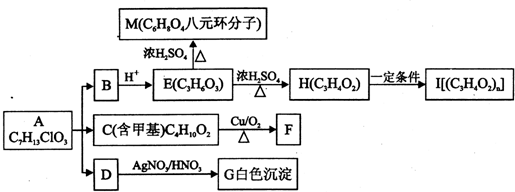
 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$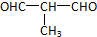 +2H2O.
+2H2O.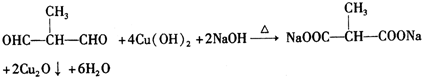 .
.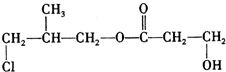
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 ⑥-C6H5 ⑦Br-⑧-COOH ⑨-CH3其中不是官能團的是( )
⑥-C6H5 ⑦Br-⑧-COOH ⑨-CH3其中不是官能團的是( )| A. | ①③④⑥⑧ | B. | ②④⑥⑦⑨ | C. | ②③⑤⑦⑧ | D. | ①③⑤⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3C≡CCH3 | B. | CH2=CH2 | C. | CH≡CCH3 | D. | CH2=CHCH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鈉的化合物在生產生活中應用廣泛.
鈉的化合物在生產生活中應用廣泛.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 單質的顏色逐漸加深 | B. | 氣態氫化物的沸點:HCl>HBr>HI | ||
| C. | 酸性:HF<HCl<HBr<HI | D. | 酸性:HClO4>HBrO4>HIO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫原子的原子結構示意圖: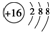 | |
| B. | 氚原子可表示為${\;}_{1}^{2}$H | |
| C. | 原子核內有10個中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 鐵位于周期表第4周期第ⅧB族 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com