
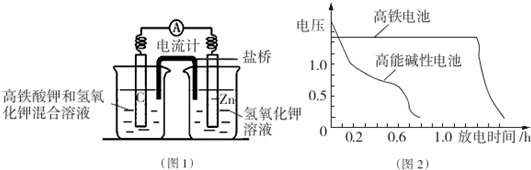
分析 Ⅰ.(1)根據電池裝置,Zn做負極,C為正極,高鐵酸鉀的氧化性很強,正極上高鐵酸鉀發生還原反應生成Fe(OH)3;根據電子轉移計算Zn的質量;
(2)鹽橋可起到平衡電荷,陰離子向負極移動,陽離子向正極移動;
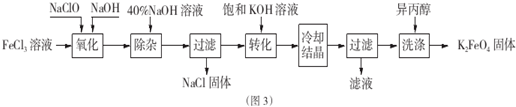
(3)由圖可知高鐵電池的優點有:使用時間長、工作電壓穩定;
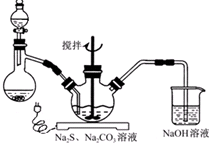
Ⅱ.氯化鐵溶液中加入次氯酸鈉和氫氧化鈉,發生反應為:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,將Na2FeO4粗產品在40%KOH溶液中溶解,過濾除去雜質NaCl,加入飽和KOH溶液后,將Na2FeO4轉化為溶解度更小的K2FeO4,反應方程式為Na2FeO4+2KOH=K2FeO4+2NaOH,冷卻結晶、過濾,高鐵酸鉀易溶于水,難溶于異丙醇,用異丙醇代替水洗滌產品可以減少高鐵酸鉀的損耗,同時洗去高鐵酸鉀晶體表面的KOH和其他雜質,得到純產品高鐵酸鉀.
(4)其中Fe元素化合價由+3價升高為+6價,共升高3價,Cl元素化合價由+1價降低為-1,價,共降低2價,化合價升降最小公倍數為6,則FeCl3的系數為2、NaClO的系數為3,再根據原子守恒配平;所含元素化合價降低的反應物是氧化劑;
(5)加入飽和KOH溶液可以增大K+的濃度,減小高鐵酸鉀的溶解,促進高鐵酸鉀晶體析出;
(6)根據Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38計算開始沉淀時c(OH-),再根據水的離子積計算溶液中c(H+),根據稀釋定律計算需要鹽酸的體積.
解答 解:Ⅰ.(1)根據電池裝置,Zn做負極,C為正極,高鐵酸鉀的氧化性很強,正極上高鐵酸鉀發生還原反應生成Fe(OH)3,正極電極反應式為:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-,若維持電流強度為1A,電池工作十分鐘,通過電子為$\frac{1A×600s}{96500C/mol}$,則理論消耗Zn為$\frac{1A×600s}{96500C/mol}$×$\frac{1}{2}$×65g/mol=0.2g,
故答案為:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-;0.2;
(2)鹽橋中陰離子移向負極移動,鹽橋起的作用是使兩個半電池連成一個通路,使兩溶液保持電中性,起到平衡電荷,構成閉合回路,放電時鹽橋中氯離子向右移動,用某種高分子材料制成陽離子交換膜代替鹽橋,則鉀離子向左移動,
故答案為:右;左;
(3)由圖可知高鐵電池的優點有:使用時間長、工作電壓穩定,
故答案為:使用時間長、工作電壓穩定;
Ⅱ.氯化鐵溶液中加入次氯酸鈉和氫氧化鈉,發生反應為:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,將Na2FeO4粗產品在40%KOH溶液中溶解,過濾除去雜質NaCl,加入飽和KOH溶液后,將Na2FeO4轉化為溶解度更小的K2FeO4,反應方程式為Na2FeO4+2KOH=K2FeO4+2NaOH,冷卻結晶、過濾,高鐵酸鉀易溶于水,難溶于異丙醇,用異丙醇代替水洗滌產品可以減少高鐵酸鉀的損耗,同時洗去高鐵酸鉀晶體表面的KOH和其他雜質,得到純產品高鐵酸鉀.
(4)其中Fe元素化合價由+3價升高為+6價,共升高3價,Cl元素化合價由+1價降低為-1,價,共降低2價,化合價升降最小公倍數為6,則FeCl3的系數為2、NaClO的系數為3,再根據原子守恒配平后反應方程式為:2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O,NaClO是氧化劑,
故答案為:2、10、3、2、9、5;NaClO;
(5)加入飽和KOH溶液可以增大K+的濃度,減小高鐵酸鉀的溶解,促進高鐵酸鉀晶體析出,
故答案為:減小高鐵酸鉀的溶解,促進高鐵酸鉀晶體析出;
(6)溶液中c(Fe3+)=5mol/L,根據Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,可知開始沉淀時c(OH-)=2×10-13mol/L,則溶液中c(H+)=$\frac{1{0}^{-14}}{2×1{0}^{-13}}$mol/L=0.05mol/L,根據稀釋定律,需要鹽酸的體積為$\frac{0.05mol/L×100ml}{2mol/L}$=2.5mL,
故答案為:2.5.
點評 本題考查原電池工作原理、物質制備工藝流程,側重考查物質制備方法的分析應用,掌握物質性質和平衡移動原理以及化學電池工作原理是解題關鍵,(1)中電極反應式書寫為難點,題目應該給出一定的信息,題目難度中等.


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 NaCN為劇毒無機物.某化學興趣小組查閱資料得知,實驗室里的氰化鈉溶液可使用硫代硫酸鈉溶液進行統一解毒銷毀,他們開展了以下三個實驗,根據要求回答問題:
NaCN為劇毒無機物.某化學興趣小組查閱資料得知,實驗室里的氰化鈉溶液可使用硫代硫酸鈉溶液進行統一解毒銷毀,他們開展了以下三個實驗,根據要求回答問題:
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
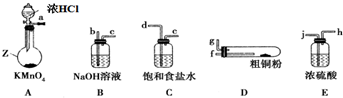

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 改變溫度和使用催化劑都能改變化學反應速率 | |
| B. | 利用丁達爾效應可以區別FeCl3溶液和Fe(OH)3膠體 | |
| C. | 根據△G=△H-T△S推測:△H<0的化學反應都可以自發進行 | |
| D. | 將AlCl3溶液蒸干并灼燒,所得固體為Al2O3 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
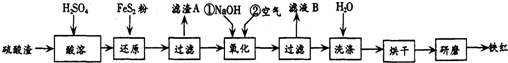
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 開始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蛋白質屬于天然有機高分子化合物,沒有蛋白質就沒有生命 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白質變性 | |
| C. | 某些蛋白質跟濃硝酸作用會變黃 | |
| D. | 可以采用多次鹽析或多次滲析的方法分離、提純蛋白質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蒸發操作時,應使混合物中的水分完全蒸干后,才能停止加熱 | |
| B. | 蒸餾操作時,應使溫度計水銀球靠近蒸餾燒瓶的支管口處 | |
| C. | 分液操作時,分液漏斗中下層液體從下口放出,上層液體從上口倒出 | |
| D. | 用干燥潔凈的玻璃棒蘸取待測溶液,滴在pH試紙上,再跟標準比色卡比較得到該溶液的pH值 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3NO2+H2O═2HNO3+NO | B. | 4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2 | ||
| C. | 3Cl2+8NH3═N2+6NH4Cl | D. | 2Na+2NH3(液)═2NaNH2+H2↑ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com