
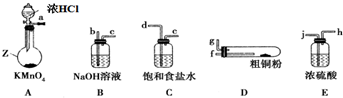

分析 I.實驗室中以粗銅(含雜質Fe)為原料制備銅的氯化物,濃鹽酸和高錳酸鉀發生反應生成氯氣,氯氣中混有氯化氫和水,可用飽和食鹽水除去氯化氫,用濃硫酸干燥,加熱時硬質試管中銅和氯氣反應生成氯化銅,用氫氧化鈉溶液吸收氯氣尾氣,防止污染空氣,
(1)儀器A為圓底燒瓶;
(2)KMnO4與濃鹽酸制取的Cl2含有HCl和H2O,用飽和食鹽水除去HCl,用濃硫酸除去H2O,然后Cl2與Cu反應,最后用NaOH溶液吸收未反應的Cl2,防止污染空氣;
(3)利用止水夾夾住導氣管的橡皮管,從長頸漏斗中加水至漏斗內外形成液面高度差,一段時間內,液面高度差不變,說明氣密性良好;
(4)D中發生反應有:氯氣與Cu反應生成氯化銅,與Fe反應生成氯化鐵;
(5)裝置B吸收未反應的氯氣,反應生成NaCl、NaClO,NaClO具有漂白性,鋼鐵制品表面生成紅褐色沉淀、溶液會失去漂白、殺菌消毒功效,說明ClO-在正極上得電子,發生還原反應生產Cl-,由于為堿性條件,還生成OH-;
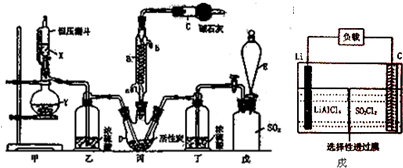
Ⅱ.粗銅(含雜質Fe)與氯氣反應生成氯化鐵和氯化銅,加稀鹽酸溶解,形成氯化鐵和氯化銅溶液,再加CuO或氫氧化銅等調節pH,使鐵離子轉化為氫氧化鐵沉淀,過濾得到的固體為氫氧化鐵,溶液2為氯化銅溶液,通入二氧化硫,二氧化硫與銅離子發生氧化還原反應生成CuCl,氯化銅溶液在HCl氛圍中蒸發結晶得到CuCl2•2H2O;
(3)由2Cu2++4I-=2CuI↓+I2、I2+2S2O32-=S4O42-+2I-,可得關系式2n(ClCl2)~I2~2n(S2O32-),據此計算200mL溶液中n(ClCl2),進而計算ClCl2的質量分數.
解答 解:I.(1)根據裝置圖可知,裝置A中儀器Z的名稱為圓底燒瓶,
故答案為:圓底燒瓶;
(2)儀器連接順序:Cl2發生裝置→除去HCl氣體裝置→干燥裝置→制備裝置→多余Cl2處理裝置,所以各儀器接口順序是:a→d、e→j、h→f、g→b;該實驗中有有毒氣體參加反應,所以實驗前要檢驗裝置的氣密性;
故答案為:d;e;j;h;f;g;b;
(3)檢驗裝置A的氣密性的方法是:用彈簧夾夾住a處橡皮管并關閉分液漏斗的活塞,向分液漏斗中加入較多的水,然后打開分液漏斗的活塞,使水緩緩流下,若分液漏斗中的水不能完全漏下,說明裝置氣密性好(或在a管處接一導管,并將導管末端插入水中,同時關閉分液漏斗的活塞,用酒精燈給圓底燒瓶微熱,若導管末端有氣泡冒出,且停止加熱恢復室溫時,導管末端形成一段小水柱,說明裝置氣密性好),
故答案為:用彈簧夾夾住a處橡皮管并關閉分液漏斗的活塞,向分液漏斗中加入較多的水,然后打開分液漏斗的活塞,使水緩緩流下,若分液漏斗中的水不能完全漏下,說明裝置氣密性好(或在a管處接一導管,并將導管末端插入水中,同時關閉分液漏斗的活塞,用酒精燈給圓底燒瓶微熱,若導管末端有氣泡冒出,且停止加熱恢復室溫時,導管末端形成一段小水柱,說明裝置氣密性好);
(4)硬質試管中發生反應有:氯氣與Cu反應生成氯化銅,與Fe反應生成氯化鐵,反應方程式分別為:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2、2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
故答案為:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2、2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(5)根據題意,裝置B中溶液含有次氯酸鈉,有強氧化性,所以鋼鐵(含Fe、C)在該溶液中會被次氯酸根氧化,所以該電化學腐蝕過程中,次氯酸根作氧化劑在正極發生還原反應,正極反應式為ClO-+2e-+H2O═Cl-+2OH-,
故答案為:ClO-+2e-+H2O═Cl-+2OH-;
Ⅱ.(1)固體中主要是氯化鐵和氯化銅,在水溶液中能水解,所以用稀鹽酸溶解固體可以抑制其水解,
故答案為:抑制Cu2+、Fe3+水解;
(2)根據信息可知:在加熱條件下,SO2與銅離子反應生成CuCl白色沉淀和SO42-,其反應的離子方程式為:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
故答案為:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
(3)由2Cu2++4I-=2CuI↓+I2、I2+2S2O32-=S4O42-+2I-,可得關系式2n(ClCl2)~I2~2n(S2O32-),故200mL溶液中n(ClCl2)=n(S2O32-)=0.02L×0.2mol/L×$\frac{200mL}{2mL}$=0.4mol,則樣品中m(ClCl2)=0.4mol×135g/mol=54g,則ClCl2的質量分數為$\frac{54g}{65g}$×100%=83.1%,故答案為:83.1%.
點評 本題考查物質的制備實驗方案、化學工藝流程,涉及對裝置及操作的分析評價、氣密性檢驗、電化學腐蝕、滴定計算等,側重于基礎知識的綜合應用,難度中等.


 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH、Al--電解質 | B. | C2H4、O2--易燃氣體 | ||
| C. | CaC2、K--遇濕易燃物品 | D. | KMnO4、KClO3--還原劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
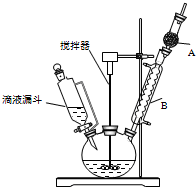 三苯甲醇(C6H5)3C-OH是一種重要的化工原料和醫藥中間體.實驗室合成三苯甲醇的實驗裝置如圖所示.
三苯甲醇(C6H5)3C-OH是一種重要的化工原料和醫藥中間體.實驗室合成三苯甲醇的實驗裝置如圖所示.| 物質 | 沸點/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應物總能量為679kj | |
| B. | 生成物總能量為431kj | |
| C. | 氫氣和氯氣反應生成2mol氯化氫氣體,反應放出183kJ能量 | |
| D. | 氫氣和氯氣反應生成2mol氯化氫氣體,反應吸收183kJ能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
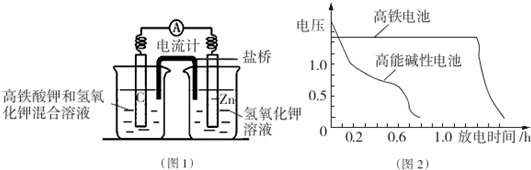
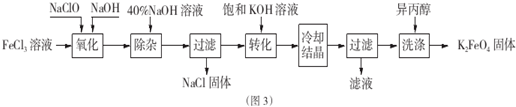
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙醇的分子式:CH3CH2OH | B. | 次氯酸的電子式: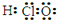 | ||
| C. | NH4Cl的電子式: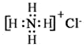 | D. | 乙醛結構簡式:CH3CHO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com