
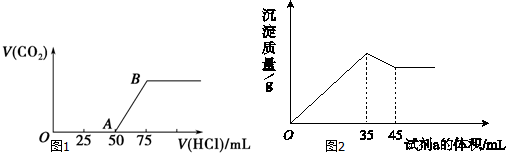
分析 當生成CO2氣體時,發生反應NaHCO3+HCl=NaCl+H2O+CO2↑,由圖可知,生成CO2氣體至最大,消耗HCl為75mL,若二氧化碳與NaOH反應后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將Na2CO3轉化為NaHCO3應消耗HCl為25mL,而圖象中開始生成CO2氣體時消耗HCl體積為50mL,說明該階段還發生反應:NaOH+HCl=NaCl+H2O,溶液中溶質為NaOH、Na2CO3,
(1)根據發生的反應書寫離子方程式;
(2)中和NaOH消耗HCl的體積為50mL-25mL=25mL,根據反應消耗鹽酸的體積計算NaOH、Na2CO3的物質的量之比;
(3)生成二氧化碳消耗消耗25mL鹽酸,根據NaHCO3+HCl=NaCl+H2O+CO2↑計算二氧化碳體積;
(4)生成CO2氣體最大時,此時溶液中溶質為NaCl,根據鈉離子、氯離子守恒可知n(NaOH)=n(NaCl)=n(HCl),進而計算氫氧化鈉的濃度;
(5)由圖象可知,當加入NaOH溶液的體積為35ml時,沉淀的質量達到最大值,則此時溶液的溶質只有NaCl,根據Na元素守恒計算;根據溶解氫氧化鋁消耗10ml NaOH溶液,就能知Al(OH)3的物質的量,從而就能求出氧化鋁的質量以及在混合物中的質量分數.
解答 解:當生成CO2氣體時,發生反應NaHCO3+HCl=NaCl+H2O+CO2↑,由圖可知,生成CO2氣體至最大,消耗HCl為75mL,若二氧化碳與NaOH反應后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將Na2CO3轉化為NaHCO3應消耗HCl為25mL,而圖象中開始生成CO2氣體時消耗HCl體積為50mL,說明該階段還發生反應:NaOH+HCl=NaCl+H2O,溶液中溶質為NaOH、Na2CO3,
(1)由上述分析可知OA段所發生反應的離子方程式為:H++OH-═H2O、CO32-+H+═HCO3-,
故答案為:H++OH-═H2O、CO32-+H+═HCO3-;
(2)中和NaOH消耗HCl的體積為50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物質的量之比等于兩個過程分別消耗鹽酸的體積之比,故NaOH、Na2CO3的物質的量之比=25mL:25mL=1:1,濃度之比是1:1,
故答案為:NaOH、Na2CO3;1:1;
(3)生成二氧化碳消耗消耗25mL鹽酸,根據NaHCO3+HCl=NaCl+H2O+CO2↑,可知CO2體積(標準狀況下)為0.025L×0.1mol/L×22.4L/mol=0.056L=56mL,
故答案為:56;
(4)生成CO2氣體最大時,此時溶液中溶質為NaCl,根據鈉離子、氯離子守恒可知n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故原氫氧化鈉溶液的濃度=$\frac{0.0075mol}{0.01L}$=0.75mol/L,
故答案為:0.75mol/L;
(5)當加入NaOH溶液的體積為35ml時,n(NaOH)=0.035L×10mol/L=0.35mol,此時沉淀的質量達到最大值,則此時溶液的溶質只有NaCl,根據Na元素守恒,則有:n(HCl)=n(NaCl)=n(NaOH)=0.35mol,
c(HCl)=$\frac{0.35mol}{0.1L}$=3.5mol/L,
由圖象可知,生成的氫氧化鋁溶解消耗的NaOH為10ml,設Al(OH)3為 Xmol,
Al(OH)3 ~NaOH
1 mol 1 mol
x mol 10mol•L-1×0.01L
解得:x=0.1 mol,
而 2Al(OH)3 ~Al2O3 由此可知,n(Al2O3)═0.05 mol
鋁土礦中 Al2O3 的質量分數為:ω%=$\frac{0.05mol×102g/mol}{6g}$=85%,
故答案為:3.5 mol•L-1;85%.
點評 本題以框圖題形式考查了鋁的化合物的性質、離子方程式的計算,題目難度中等,明確發生反應的實質為解答關鍵,試題知識點較多、綜合性較強,充分考查了學生的分析、理解能力及化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 能使甲基橙變紅的溶液中:NH4+、Mg2+、SO42-、NO3- | |
| B. | 1.0 mol•L-1FeCl3溶液:Na+、Cl-、NO3-、SCN- | |
| C. | 1.0 mol•L-1的KNO3溶液中:Fe2+、H+、Cl-、SO42- | |
| D. | 與Al反應能放出H2的溶液中:Na+、Cl-、HCO3-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 編碼 | 實驗 | 現象 |
| A | 加熱放在坩堝中的小塊鈉 | 鈉先融化成光亮的小球,燃燒時,火焰為黃色,燃燒后,生成淡黃色固體 |
| B | 在酒精燈上加熱鋁箔 | 鋁箔融化,失去光澤,融化的鋁并不滴落,好像一層膜兜著 |
| C | 在空氣中久置的鋁條放入NaOH溶液中 | 鋁條立刻產生大量無色氣泡,鋁條逐漸變細,鋁條逐漸發熱 |
| D | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快變為灰綠色,最后變為紅褐色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
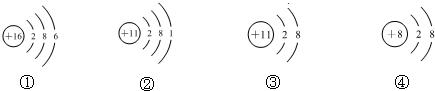
| A. | 它們表示四種元素 | |
| B. | ②③的化學性質相同 | |
| C. | ②表示的元素是金屬元素 | |
| D. | ①表示的是原子,而④表示的是陰離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 目前流行的關于生命起源假設的理論認為,生命起源于約40億年前的古洋底的熱液環境,這種環境系統中普遍存在鐵硫簇結構,如Fe2S2、Fe4S4、Fe8S7等,這些鐵硫簇結構參與了生命起源的相關反應.某化學興趣小組在研究某鐵硫簇結構的組成時,設計了下列實驗.
目前流行的關于生命起源假設的理論認為,生命起源于約40億年前的古洋底的熱液環境,這種環境系統中普遍存在鐵硫簇結構,如Fe2S2、Fe4S4、Fe8S7等,這些鐵硫簇結構參與了生命起源的相關反應.某化學興趣小組在研究某鐵硫簇結構的組成時,設計了下列實驗.| 滴定次數 | 待測溶液體積/mL | 草酸溶液體積/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
| 編號 | 溫度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色時間/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

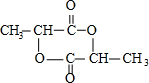 ;
; )在一定條件下可發生類似反應①的反應,生成芳香族聚碳酸酯,寫出反應的化學方程式:2n
)在一定條件下可發生類似反應①的反應,生成芳香族聚碳酸酯,寫出反應的化學方程式:2n +n
+n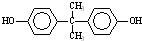 →
→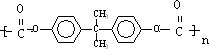 +4nCH3OH.
+4nCH3OH.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D | |
| 用品 |  |  |  |  |
| 主要成分 | Fe | NaHCO3 | Si | Fe2O3 |
| 用途 | 可運輸濃硫酸 | 發酵 | 光導纖維 | 涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
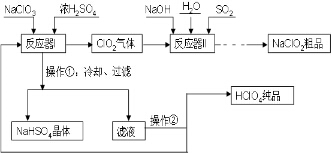 工業上生產高氯酸(沸點:90°C)時還同時生產了亞氯酸鈉,其工藝流程如下:
工業上生產高氯酸(沸點:90°C)時還同時生產了亞氯酸鈉,其工藝流程如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com