
| 5×112(W2-W1) |
| 160a |
| 5×112(W2-W1) |
| 160a |
| 1 |
| 5 |
| 112 |
| 160 |
| 5×112(W2-W1) |
| 160a |
| 5×112(W2-W1) |
| 160a |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:

| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

10(W2-W1)×
| ||
| a |
10(W2-W1)×
| ||
| a |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年山東省菏澤市高三5月份模擬考試化學試卷(解析版) 題型:實驗題
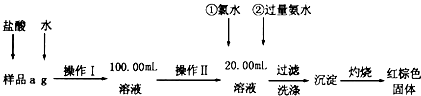
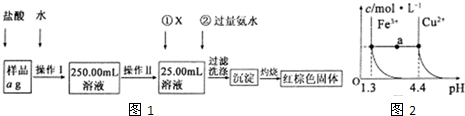
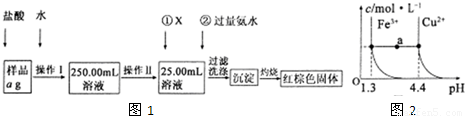
某氯化鐵樣品含有少FeC12雜質。現要測定其中鐵元素的質量分數,實驗按以下步驟進行:
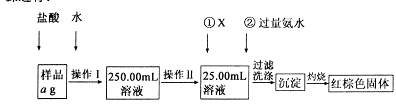
請根據上圖流程,回答以下問題:
(1)操作Ⅰ所用到的玻璃儀器除燒杯、玻璃棒外,還必須有 、 (填儀器名稱),操作Ⅱ必須用到的儀器是 (填編號)。
A.50mL燒杯 B.50mL量筒 C.100mL量筒 D.25mL酸式滴定管
(2)①的X可選用(填化學式),其目的是 。加入氨水要過量的原因是 。
(3)檢驗沉淀是否已經洗滌干凈的操作是 。
(4)若蒸發皿質量是W1g,蒸發皿與加熱后固體總質量W2g,則樣品中鐵元素的質量分數是 (列出計算式,不需化簡):若固體加熱時未充分反應,則最終測量的結果 (“偏大”、“偏小”、“不變”)。
(5)已知在常溫下Cu2+和Fe3+在溶液中隨pH變化時水解的曲線如圖所示
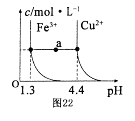 。
。
對圖中a點的說法正確的是 (填序號)。
①加適量NH4C1固體可使溶液由a點沿水平方向變到Cu2+曲線上。
②溶液中a點和水平線在Fe3+和Cu2+曲線上任意截點的C(H+)與c(OH-)乘積相等
③Fe(OH)3、Cu(OH)2在a點代表的溶液中均達到飽和
查看答案和解析>>
科目:高中化學 來源:菏澤二模 題型:問答題
查看答案和解析>>
科目:高中化學 來源:2013年山東省菏澤市高考化學二模試卷(解析版) 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com