
【題目】某研究性學習小組設計了一組實驗來探究元素周期律。
甲同學根據(jù)元素非金屬性與對應最高價含氧酸之間的關系,設計了如圖1裝置來一次性完成同主族元素非金屬性強弱比較的實驗研究;
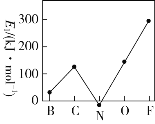
乙同學設計了如圖2裝置來驗證鹵族元素性質的遞變規(guī)律,A、B、C三處分別是蘸有溴化鈉溶液的棉花、濕潤的淀粉碘化鉀試紙、濕潤的紅色紙條。
已知常溫下濃鹽酸與高錳酸鉀能反應生成氯氣;
可選擇的試劑有:大理石、碳酸鈉粉末、濃鹽酸、稀硝酸、硅酸鈉溶液。
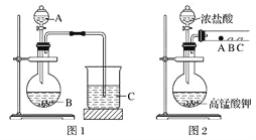
(1)甲同學實驗中(圖1):
①從給出試劑中選出最佳物質(填化學式):A________,B________。
②燒杯C中發(fā)生反應的離子方程式為__________________________。
(2)乙同學實驗中(圖2):
①寫出A處反應的離子方程式________________________。
②B處實驗現(xiàn)象是________________________。
③若高錳酸鉀的還原產(chǎn)物為Mn2+,當有0.04 mol高錳酸鉀參加反應時,則可生成標準狀況下的氯氣的體積為______________________。
【答案】HNO3 CaCO3 CO2+SiO32-+H2O===H2SiO3↓+CO32- Cl2+2Br-===Br2+2Cl- 試紙變藍 2.24 L
【解析】
(1)根據(jù)信息知道:甲同學根據(jù)元素非金屬性與對應最高價含氧酸之間的關系如圖1裝置來一次性完成N、C、Si三種非金屬元素的非金屬性強弱比較,根據(jù)強酸制弱酸來回答即可;
(2)根據(jù)氧化性強的單質可以將氧化性弱的單質從其鹽中置換出來結合反應產(chǎn)物確定實驗現(xiàn)象,根據(jù)化學方程式計算氯氣體積,或者得失電子數(shù)相等列關系式計算。
(1)甲同學實驗中(圖1):
①根據(jù)題干信息:甲同學根據(jù)元素非金屬性與對應最高價含氧酸之間的關系,設計了如圖1裝置來一次性完成同主族元素非金屬性強弱比較的實驗研究,硝酸的酸性強于碳酸,碳酸酸性強于硅酸,最高價氧化物對應水化物酸性越強,則原子的非金屬性越強,所以A為稀硝酸,B為碳酸鈣,C為硅酸鈉;
答案: HNO3 CaCO3
②圖1燒杯中為二氧化碳與硅酸鈉反應生成硅酸沉淀和碳酸鈉,其反應的離子方程式為:SiO32-+CO2+H2O═H2SiO3↓+CO32-;
答案:CO2+SiO32-+H2O===H2SiO3↓+CO32-
(2)乙同學實驗中(圖2):
①根據(jù)題干信息:乙同學設計了如圖裝置來驗證鹵族元素性質的遞變規(guī)律,所以乙同學的實驗原理是同主族單質氧化性越強陰離子還原性越弱,對應元素非金屬越強,高錳酸鉀和濃鹽酸反應會產(chǎn)生氯氣,氯氣具有氧化性,能將溴離子,碘離子氧化為對應的,即A處:Cl2+2Br-=2Cl-+Br2;
答案:Cl2+2Br-=2Cl-+Br2。
②B處反應:Cl2+2I-=2Cl-+I2,所以B處的現(xiàn)象變藍,剩余的氯氣能使?jié)駶櫦t紙褪色;
答案:試紙變藍
③若高錳酸鉀的還原產(chǎn)物為Mn2+,當有0.04 mol高錳酸鉀參加反應時,則可生成標準狀況下的氯氣的體積為______________________。
根據(jù)得失電子數(shù)相等列關系式:設氯氣生成nmol
2KMnO4~5Cl2
2mol 5mol
0.04mol nmol
n=![]() =0.1mol
=0.1mol
V=nVm=0.1mol×22.4L/mol=2.24L;
答案:2.24L。


科目:高中化學 來源: 題型:
【題目】目前汽車上使用的電瓶大多仍是鉛蓄電池,其構造示意圖如下。發(fā)生反應的化學方程式為:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),下列說法不正確的是
2PbSO4(s)+2H2O(l),下列說法不正確的是
A. 放電時,電解質溶液的pH值增大
B. 放電時,電路中轉移0.2mol電子時Pb電極質量減少20.7g
C. 放電時,溶液中H+向PbO2電極移動
D. 放電時,正極反應為:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿伏伽德羅常數(shù)的值為NA。下列說法正確的是
A.18 g H2O、D2O組成的物質中含有的電子數(shù)為10NA
B.0.2 mol鐵在足量的氧氣中燃燒,轉移電子數(shù)為0.6NA
C.50 mL 12 mol·L-1鹽酸與足量MnO2共熱,轉移的電子數(shù)為0.3NA
D.0.1 mol 熔融的KHSO4中含有0.1NA個陽離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁粉和氧化鐵粉末的混合物制成的鋁熱劑可用于焊接鋼軌。現(xiàn)取不同質量的該鋁熱劑分別和100ml同物質的量濃度的NaOH溶液反應,所取鋁熱劑的質量與產(chǎn)生氣體的體積關系如下表(氣體體積均在標準狀況下測定):
① | ② | ③ | ④ | |
鋁熱劑質量/g | 5g | 10g | 15g | 20g |
氣體體積/L | 2.24L | 4.48L | 6.72L | 6.72L |
試完成下列計算:
(1)NaOH溶液的物質的量濃度_______________。
(2)該鋁熱劑中鋁的質量分數(shù)_____________
(3)20g該鋁熱劑發(fā)生鋁熱反應理論上產(chǎn)生鐵的質量是多少?________(寫出步驟)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】非金屬和金屬單質以及相關化合物有著廣泛的應用,回答下列相關問題:
(1)銅或銅鹽的焰色反應為綠色,下列有關原理分析的敘述正確的是______(填字母)。
a. 電子從基態(tài)躍遷到較高的激發(fā)態(tài) b. 電子從較高的激發(fā)態(tài)躍遷到基態(tài)
c. 焰色反應的光譜屬于吸收光譜 d. 焰色反應的光譜屬于發(fā)射光譜
(2)In元素基態(tài)原子的價電子排布式為________。與Cu元素同周期,且基態(tài)原子有2個未成對電子的過渡元素是____(填元素符號)。
(3)第一電子親和能(E1)是元素的基態(tài)氣態(tài)原子得到一個電子形成氣態(tài)負一價離子時所放出的能量。第二周期部分元素的E1變化趨勢如圖所示。試分析碳元素的E1較大的原因:______________。
(4)[PtCl4(NH3)2]中H-N-H鍵之間的夾角____(填“>”“<”或“=”)NH3分子中H-N-H鍵之間的夾角,原因是________________。
(5)鐵、鎳易與CO作用形成羰基配合物Fe(CO)5、Ni(CO)4。1個Fe(CO)5分子中含有σ鍵數(shù)目為____;已知Ni(CO)4分子為正四面體構型,下列溶劑能夠溶解Ni(CO)4的是____(填字母)。
A. 四氯化碳 B.苯 C.水 D.液氨
(6)Fe3O4晶體中,O2-的重復排列方式如圖所示,該排列方式中存在著由如1、3、6、7的O2-圍成的正四面體空隙和由3、6、7、8、9、12的O2-圍成的正八面體空隙。Fe3O4中有一半的Fe3+填充在正四面體空隙中,另一半Fe3+和Fe2+填充在正八面體空隙中,則Fe3O4晶體中,正四面體空隙數(shù)與O2-數(shù)之比為____。Fe3O4晶胞中有8個圖示結構單元,晶體密度為5.18 g·cm-3,則該晶胞參數(shù)a=_____cm(寫出計算表達式即可)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據(jù)下圖所示實驗,回答問題:
(1)實驗① 觀察到的現(xiàn)象是________________________。實驗②
觀察到的現(xiàn)象是________________________。實驗② 觀察到的現(xiàn)象是________________________。
觀察到的現(xiàn)象是________________________。
(2)實驗③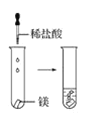 觀察到的現(xiàn)象是________________________。實驗④
觀察到的現(xiàn)象是________________________。實驗④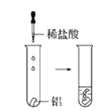 觀察到的現(xiàn)象是________________________。
觀察到的現(xiàn)象是________________________。
(3)由上述實驗,你能得出的結論是________________________。
(4)請總結同周期元素金屬性的變化規(guī)律__________,并用原子結構解釋其原因_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與科學、技術、社會、環(huán)境密切相關,下列說法正確的是( )
A.SiO2具有導電性,可用于制作光導纖維和光電池
B.煤經(jīng)過氣化和液化等物理變化可轉化為清潔燃料
C.乙酰胺(![]() )與甘氨酸的化學性質相同
)與甘氨酸的化學性質相同
D.屠呦呦用乙醚從青蒿中提取出對治療瘧疾有特效的青蒿素,該過程包括萃取操作
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在1200℃時,天然氣脫硫工藝中會發(fā)生下列反應
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
則ΔH4的正確表達式為
A.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)B.ΔH4=
(ΔH1+ΔH2-3ΔH3)B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)D.ΔH4=
(ΔH1+ΔH2-3ΔH3)D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水化學資源開發(fā)利用的部分過程如圖所示,下列說法正確的是( )
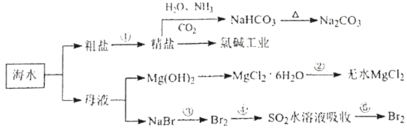
A.用澄清的石灰水可鑒別NaHCO3和Na2CO3
B.從海水中得到粗鹽主要是通過蒸發(fā)操作實現(xiàn)的
C.在步驟③,中可通入Cl2使溴離子被還原為Br2
D.在步驟④中,SO2水溶液吸收Br2后,溶液的pH增大
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com