

分析 (1)根據溶液的pH大小來判斷溶液的酸堿性強弱;
(2)弱堿的電離是分步進行的,根據電離方程式的書寫方法來回答;
(3)用0.10mol•L-1鹽酸滴定20.00mL0.10mol•L-1的R0H溶液(B),堿是弱堿,二者之間反應得到強酸弱堿鹽,顯示酸性,據此回答.
解答 解:(1)根據圖象判斷,等濃度的堿A和B,0.10mol•L-1的M0H溶液(A)pH=13,所以是強堿,故答案為:強堿;0.10mol•L-1的M0H溶液(A)pH=13;
(2)0.10mol•L-1的R0H溶液(A)pH<13,所以是弱堿,部分電離,電離方程式為:ROH?R++OH-;故答案為:ROH?R++OH-;
(3)0.10mol•L-1鹽酸滴定20.00mL0.10mol•L-1的R0H溶液(B),堿是弱堿,二者之間反應得到強酸弱堿鹽,顯示酸性,pH=7對應的溶液是RCl和剩余的ROH的混合物,根據電荷守恒:c(R+)+c(H+)=c(OH-)+c(Cl-),pH=7對應的溶液中,c(H+)=c(OH-),所以c(R+)=c(Cl-),溶液濃度大小排序為:c(R+)=c(Cl-)>c(H+)=c(OH-),故答案為:(R+)=c(Cl-)>c(H+)=c(OH-).
點評 本題涉及酸堿中和滴定以及溶液中離子濃度大小比較方面的知識,注意溶液的組成以及若酸堿的不完全電離是解題的關鍵,難度中等.


 ABC考王全優卷系列答案
ABC考王全優卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | FeCl2(FeCl3)--加入足量鐵粉,然后過濾,Fe+2FeCl3═3FeCl2 | |
| B. | NaCl(NaI)--加入適量氯水,用CCl4萃取分液,Cl2+2NaI═2NaCl+I2 | |
| C. | SiO2(Al2O3)--加入足量NaOH溶液,然后過濾,Al2O3+2NaOH═2NaAlO2+H2O | |
| D. | CaCl2(NH4Cl) 固體混合物--直接加熱NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH2=CH2+Br2(CCl4)→ | B. | CH2=CH-CH2-CH3+HCl$→_{△}^{催化劑}$ | ||
| C. | C(CH3)4+Cl2$\stackrel{光照}{→}$ | D. | n CH3-CH=CH2$→_{△}^{催化劑}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe3+ | B. | Cr2O${\;}_{7}^{2-}$ | C. | Br2 | D. | HNO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

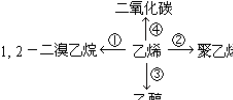
 ③CH2=CH2+H2O$\stackrel{一定條件}{→}$CH3CH2OH④CH2=CH2+3O2$\stackrel{點燃}{→}$2CO2+2H2O.
③CH2=CH2+H2O$\stackrel{一定條件}{→}$CH3CH2OH④CH2=CH2+3O2$\stackrel{點燃}{→}$2CO2+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| B. | 向漂白粉溶液中加入過量濃鹽酸:ClO-+H+=HClO | |
| C. | “萬能還原劑”NaBH4與水反應得到NaBO2:BH4-+2H2O=BO2-+4H2↑ | |
| D. | 向FeSO4溶液中加入Na2O2:2Na2O2+2Fe2++2H2O=4Na++2Fe(OH)2↓+O2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某實驗小組設計用50mL 1.0mol/L鹽酸跟50mL 1.1mol/L氫氧化鈉溶液在上圖裝置中進行中和反應.在大燒杯底部墊泡沫塑料(或紙條),使放入的小燒杯杯口與大燒杯杯口相平.然后再在大、小燒杯之間填滿碎泡沫塑料(或紙條),大燒杯上用泡沫塑料板(或硬紙板)作蓋板,在板中間開兩個小孔,正好使溫度計和環形玻璃攪拌棒通過.通過測定反應過程中所放出的熱量可計算中和熱.試回答下列問題:
某實驗小組設計用50mL 1.0mol/L鹽酸跟50mL 1.1mol/L氫氧化鈉溶液在上圖裝置中進行中和反應.在大燒杯底部墊泡沫塑料(或紙條),使放入的小燒杯杯口與大燒杯杯口相平.然后再在大、小燒杯之間填滿碎泡沫塑料(或紙條),大燒杯上用泡沫塑料板(或硬紙板)作蓋板,在板中間開兩個小孔,正好使溫度計和環形玻璃攪拌棒通過.通過測定反應過程中所放出的熱量可計算中和熱.試回答下列問題:| 實驗序號 | 起始溫度t1/℃ | 終止溫度t2/℃ | 溫差(t2-t1)/℃ | ||
| 鹽酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 30.6 | 5.5 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com