
分析 (1)①氧化還原反應中,化合價升高的數值=化合價降低數值=轉移電子數;
②反應的平衡表達式等于生成物濃度冪之積比上反應物濃度冪之積;
③化學反應是2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O是氣體計量數增大的反應,提高NOx的轉化率,平衡正向移動,由此分析解答;
(2)根據蓋斯定律來計算化學反應的焓變;
(3)根據信息知道一氧化氮和二氧化氯之間反應生成產物是硝酸、鹽酸以及二氧化氮,根據化學方程式結合電子守恒來計算;
(4)①根據圖中信息知道:CO(NH2)2與某種煙氣中的NO的物質的量比值越大,NO脫除率越大.
解答 解:(1)根據化合價升高的數值=化合價降低數值=轉移電子數,化合價升高情況:2NH3~6e-~N2,所以當有1mol N2(g)生成,該反應的電子轉移的量是6mol,總數是6NA 或6×6.02×1023,故答案為:6NA 或6×6.02×1023;
②反應的平衡表達式等于生成物濃度冪之積比上反應物濃度冪之積,所以K=$\frac{c2(N2)•c3(H2O)}{c2(NH3)•c(NO)•c(NO2)}$,故答案為:$\frac{c2(N2)•c3(H2O)}{c2(NH3)•c(NO)•c(NO2)}$;
③化學反應是2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O是氣體計量數增大的反應,提高NOx的轉化率,平衡正向移動,
a.增大NH3的濃度,反應速率加快,平衡正向移動,故正確;
b.增大N2的濃度,平衡逆向,NOx的轉化率減小,故錯誤;
c.增大壓強,平衡逆向移動,故錯誤;
d.選擇合適的催化劑,平衡不移動,故錯誤;
故選:a;
(2)根據蓋斯定律,將已知熱化學方程式②×2-①可得:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ•mol-1,故答案為:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ•mol-1;
(3)根據信息知道一氧化氮和二氧化氯之間反應生成產物是硝酸、鹽酸以及二氧化氮,反應方程式為:2NO+ClO2+H2O=NO2+HNO3+HCl,根據物質的性質及化合價變化可知:2NO~5e-~NO2+HNO3,ClO2~5e-~HCl,所以有2NO2~ClO2.根據物質的性質及化合價變化可知:2NO2~8e-~N2,Na2SO3~2e-~Na2SO4,所以有2NO2~4 Na2SO3.根據關系式有:2ClO2~2NO2~N2,n(ClO2)=2n(NO2)=1 mol,m(ClO2)=67.5g,
故答案為:2NO+ClO2+H2O=NO2+HNO3+HCl;67.5.
點評 本題涉及氧化還原反應中的概念、蓋斯定律的應用、化學平衡的有關計算等綜合知識,注意知識的遷移和應用是關鍵,難度大.


科目:高中化學 來源: 題型:解答題
 某化學興趣小組為了探究某些氣體的性質,設計了如圖所示的實驗裝置.實驗時將A、D中產生的氣體同時通入C中.(K為止水夾,部分夾持儀器已略去)
某化學興趣小組為了探究某些氣體的性質,設計了如圖所示的實驗裝置.實驗時將A、D中產生的氣體同時通入C中.(K為止水夾,部分夾持儀器已略去)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 石蕊試液 | 品紅溶液 | 飽和硫化氫溶液 | 氯水 | |
| A | 無色 | 無色 | 乳白色渾濁 | 無色 |
| B | 紅色 | 無色 | 黃色渾濁 | 無色 |
| C | 紅色 | 無色 | 乳白色渾濁 | 黃綠色 |
| D | 無色 | 無色 | 乳白色渾濁 | 黃綠色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子式為C3H6Cl2的同分異構體有四種 | |
| B. | 分子式為C8H10的芳香烴有3個,分別為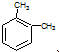 、 、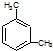 和 和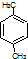 | |
| C. | 分子式為C4H8的烯烴同分異構體有2個,分別為CH2=CHCH2CH3、CH3CH=CHCH3 | |
| D. | 二氯甲烷有兩種同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ca2+:1s22s22p63s23p6 | B. | O:1s22s22p6 | ||
| C. | P:1s22s22p63s23p3 | D. | Br:1s22s22p63s23p63d104s24p5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
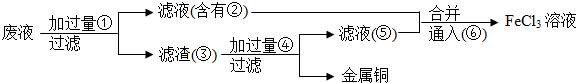
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 人體缺碘,可通過食用加碘鹽補碘 | |
| B. | 缺鐵性貧血,可通過食用鐵強化醬油預防 | |
| C. | 鋅攝入量過多,也會引起缺鐵性貧血 | |
| D. | 為了防止齲齒,人人都適合使用含氟牙膏 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 明礬可用于凈水 | |
| B. | 氯水保存在棕色瓶中,并置于冷暗處 | |
| C. | 氯元素在自然界主要以氯氣形式存在 | |
| D. | 氯氣被廣泛用于醫藥合成、農藥生產等方面 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com