
中學常見的某反應的化學方程式為a+b―→c+d+H2O(未配平,反應條件已略去)。
請回答下列問題:
(1)若a是鐵,b是稀硝酸(過量),且a可溶于c溶液中。則a與b反應的離子方程式為
___________________________。
(2)若c、d為氣體,且都能使澄清石灰水變渾濁,則將此混合氣體通入溴水中,橙色褪去,寫出其褪色過程中發生反應的離子方程式:___________________________。
(3)若c是無色有刺激性氣味的氣體,其水溶液顯弱堿性,在標準狀況下用排空氣法收集c氣體,得平均摩爾質量為20 g·mol-1的混合氣體進行噴泉實驗。假設溶質不擴散,實驗完成后燒瓶中所得溶液的物質的量濃度為________mol·L-1(小數點后保留2位有效數字)。
(4)若a是造成溫室效應的主要氣體,c、d均為鈉鹽,參加反應的a、b的物質的量之比為4:5。則上述反應的離子方程式為____________________________。
(1)Fe+4H++NO3—=Fe3++NO↑+2H2O
(2)SO2+2H2O+Br2=4H++SO42—+2Br-
(3)0.045
(4)4CO2+5OH-=3HCO3—+CO42—+H2O
【解析】(1)稀硝酸與鐵反應,硝酸足量,則生成硝酸鐵,且鐵溶于硝酸鐵,反應的離子方程式為Fe+4H++NO3—=Fe3++NO↑+2H2O。(2)常見的氣體中能使澄清石灰水變渾濁的氣體是二氧化硫和二氧化碳,又由兩種物質反應生成兩種氣體和水知,反應為C+2H2SO4(濃)  CO2↑+2SO2↑+2H2O,具有還原性的二氧化硫能使溴水褪色,離子方程式為SO2+2H2O+Br2=4H++SO42—+2Br-。(3)無色有刺激性氣味的氣體,且水溶液顯弱堿性的只有氨氣,用向下排空氣法x?y,則 2014-03-27_154443 =20,得x/y=3。假設做噴泉實驗的燒瓶容積中氨水的體積為3 L,空氣難溶于水,噴泉實驗完成后,燒瓶中氨水的體積為3 L,所以,燒瓶中氨水的物質的量濃度為
CO2↑+2SO2↑+2H2O,具有還原性的二氧化硫能使溴水褪色,離子方程式為SO2+2H2O+Br2=4H++SO42—+2Br-。(3)無色有刺激性氣味的氣體,且水溶液顯弱堿性的只有氨氣,用向下排空氣法x?y,則 2014-03-27_154443 =20,得x/y=3。假設做噴泉實驗的燒瓶容積中氨水的體積為3 L,空氣難溶于水,噴泉實驗完成后,燒瓶中氨水的體積為3 L,所以,燒瓶中氨水的物質的量濃度為 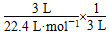 =0.045 mol·L-1。(4)造成溫室效應的主要氣體是二氧化碳,二氧化碳與氫氧化鈉溶液反應可生成碳酸鈉、碳酸氫鈉和水。當二氧化碳與氫氧化鈉的物質的量之比為4:5時,反應的離子方程式為4CO2+5OH-=3HCO3—+CO32—+H2O。
=0.045 mol·L-1。(4)造成溫室效應的主要氣體是二氧化碳,二氧化碳與氫氧化鈉溶液反應可生成碳酸鈉、碳酸氫鈉和水。當二氧化碳與氫氧化鈉的物質的量之比為4:5時,反應的離子方程式為4CO2+5OH-=3HCO3—+CO32—+H2O。
點撥:本題考查了鐵與稀硝酸反應、碳與濃硫酸反應、實驗室制氨氣原理以及二氧化碳與氫氧化鈉反應等知識,意在考查考生的離子方程式書寫能力、推理能力及數據計算能力。


科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 常見無機物及其應用練習卷(解析版) 題型:選擇題
下列敘述正確的是( )
A.Na、Al、Fe金屬單質在一定條件下與水反應都生成H2和對應的堿
B.漂白粉和明礬都常用于自來水的處理,二者的作用原理不相同
C.將SO2通入Ca(ClO)2溶液可生成CaSO3沉淀
D.過量的銅與濃硝酸反應,生成的氣體只有NO2
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化學實驗基礎練習卷(解析版) 題型:選擇題
下列實驗現象及相關結論均正確的是( )
ABCD
實驗



現象品紅褪色最后試管有淺黃色沉淀最后一滴標準液使酚酞由無色變為紅色,且30s內不復原 鹽橋左端從無色逐漸變為藍色
結論SO2有
強氧化性有機物中含有溴原子滴定達到終點金屬Ⅱ比Ⅰ活潑
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化學基本理論練習卷(解析版) 題型:選擇題
用惰性電極電解硫酸銅溶液,整個過程轉移電子的物質的量與產生氣體總體積的關系如圖所示(氣體體積均在相同狀況下測定)。欲使溶液恢復到起始狀態,可向溶液中加入( )

A.0.1 mol CuO B.0.1 mol CuCO3
C.0.1 mol Cu(OH)2 D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化學基本理論練習卷(解析版) 題型:選擇題
據媒體報道,日本食品巨頭明治公司生產的“明治STEP”奶粉中檢測出含量超標的放射性元素銫(Cs)。銫較為穩定的核素有 Cs、
Cs、 Cs、
Cs、 Cs、
Cs、 Cs。下列判斷不正確的是( )
Cs。下列判斷不正確的是( )
A.  Cs、
Cs、 Cs、
Cs、 Cs、
Cs、 Cs互為同位素
Cs互為同位素
B.  Cs、
Cs、 Cs、
Cs、 Cs、
Cs、 Cs的核外電子排布相同
Cs的核外電子排布相同
C.  Cs、
Cs、 Cs、
Cs、 Cs、
Cs、 Cs的性質和用途相同
Cs的性質和用途相同
D.  Cs、
Cs、 Cs、
Cs、 Cs、
Cs、 Cs的質量數和中子數均不同
Cs的質量數和中子數均不同
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化學基本概念練習卷(解析版) 題型:選擇題
運用有關概念判斷下列敘述正確的是( )
A.1 mol H2燃燒放出的熱量為H2的燃燒熱
B.Na2SO3與H2O2的反應為氧化還原反應
C. 和
和 互為同系物
互為同系物
D.BaSO4的水溶液不易導電,故BaSO4是弱電解質
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化學基本概念練習卷(解析版) 題型:選擇題
NA表示阿伏加德羅常數的值,下列說法正確的是( )
①用銅作電極電解飽和NaCl溶液,當線路中通過NA個電子時,陽極產生11.2 L氣體(標準狀況下) ②常溫常壓下,16 g O2和16 g O3含氧原子數均為NA ③標準狀況下,22.4 L CH3CH2OH中含有的碳原子數為2NA ④6.5 g鋅全部溶于一定量的濃硫酸,生成SO2與H2的混合氣體,氣體分子總數為0.1NA ⑤10.6 g Na2CO3粉末中含有CO32—數為0.1NA
A.②④⑤ B.①③⑤ C.①②④⑤ D.①②③
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化學反應速率與化學平衡練習卷(解析版) 題型:選擇題
在一定條件下的恒容密閉容器中發生反應:CO2(g)+3H2(g) CH3OH(g)+H2O(g),圖1表示反應過程中能量的變化,圖2表示反應過程中物質濃度的變化。下列有關說法正確的是( )
CH3OH(g)+H2O(g),圖1表示反應過程中能量的變化,圖2表示反應過程中物質濃度的變化。下列有關說法正確的是( )

A.該反應的焓變和熵變:ΔH>0,ΔS<0
B.溫度降低,該反應的平衡常數K增大
C.升高溫度,n(CH3OH)/n(CO2)增大
D.從反應開始到平衡,用氫氣表示的平均反應速率為2.25 mol/(L·min)
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習四川配套訓練 第9講非金屬元素化合物練習卷(解析版) 題型:填空題
NOx是汽車尾氣中的主要污染物之一。
(1)NOx能形成酸雨,寫出NO2轉化為HNO3的化學方程式:__________________________。
(2)汽車發動機工作時會引發N2和O2反應,其能量變化示意圖如下:
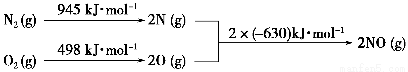
①寫出該反應的熱化學方程式:_______________________________。
②隨溫度升高,該反應化學平衡常數的變化趨勢是____。
(3)在汽車尾氣系統中裝置催化轉化器,可有效降低NOx的排放。
①當尾氣中空氣不足時,NOx在催化轉化器中被還原成N2排出。寫出NO被CO還原的化學方程式:______________________________
②當尾氣中空氣過量時,催化轉化器中的金屬氧化物吸收NOx生成鹽。其吸收能力順序如下:12MgO<20CaO<38SrO<56BaO。原因是___________________________________________,
元素的金屬性逐漸增強,金屬氧化物對NOx的吸收能力逐漸增強。
(4)通過NOx傳感器可監測NOx的含量,其工作原理示意圖如下:

①Pt電極上發生的是________反應(填“氧化”或“還原”)
②寫出NiO電極的電極反應式:______________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com