
【題目】25℃時,水中存在電離平衡:H2OH++OH- △H>0,下列敘述正確的是
A.向水中加入稀氨水,平衡逆向移動,c(OH-)降低
B.向水中加入少量固體硫酸氫鈉,c(H+)增大,KW不變
C.向水中加入少量固體CH3COONa,平衡正向移動,c(H+)增大
D.將水加熱,KW增大,pH減小,酸性增強
科目:高中化學 來源: 題型:
【題目】下列離子方程式不正確的是
A.用氨水吸收過量的二氧化硫:![]()
B.向0.5mol L-1 KAl(SO4)2溶液中滴入0.5mol L-1 Ba(OH)2溶液使![]() 恰好完全沉淀:2Ba2+ 4OH- + Al3++2
恰好完全沉淀:2Ba2+ 4OH- + Al3++2![]() =2BaSO4↓+
=2BaSO4↓+![]() +2H2O
+2H2O
C.用足量Na2S2O3溶液除去水中的 Cl2: 4Cl2+![]() +5H2O =10H++2
+5H2O =10H++2![]() +8Cl-
+8Cl-
D.少量CO2通入苯酚鈉溶液中:C6H5O-+CO2+H2O→C6H5OH+![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前,人們對環境保護、新能源開發很重視。
(1)汽車尾氣中含有CO、NO2等有毒氣體,對汽車加裝尾氣凈化裝置,可使有毒氣體轉化為無毒氣體:4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g)。恒溫恒容條件下,能夠說明該反應已達到平衡狀態的是________
4CO2(g)+N2(g)。恒溫恒容條件下,能夠說明該反應已達到平衡狀態的是________![]() 填字母代號
填字母代號![]() 。
。
A.容器內混合氣體顏色不再變化
B.容器內的壓強保持不變
C.2V逆(NO2)=V正(N2)
D.容器內混合氣體密度保持不變
(2)用活性炭還原法也可以處理氮氧化物。某研究小組向某密閉容器中加入一定量的活性炭和NO,發生反應C(s)+2NO(g)![]() N2(g)+CO2(g)△H時,反應進行到不同時間測得各物質的量濃度如下表所示:
N2(g)+CO2(g)△H時,反應進行到不同時間測得各物質的量濃度如下表所示:
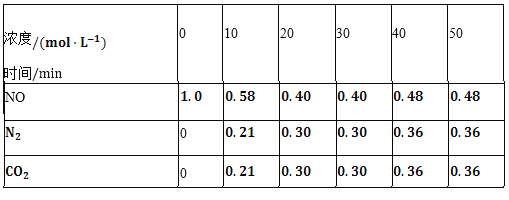
①根據表中數據分析T1℃時,該反應在0~20min的平均反應速率v(CO2)________;計算該反應的平衡常數![]() ________。
________。
②根據上表數據判斷,由30min到40min時改變的條件可能是________![]() 任寫一種
任寫一種![]() 。
。
③若30min后升高溫度至T2℃,達到新平衡時,容器中NO、N2、CO2的濃度之比為5:3:3,此時NO的轉化率________![]() 填“升高”或“降低”
填“升高”或“降低”![]() ,△H________
,△H________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。(3)以
。(3)以![]() 與
與![]() 為原料可合成化肥尿素化學式為
為原料可合成化肥尿素化學式為![]() 。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol,③H2O(l)=H2O(g)△H=+44.0kJ/mol,寫出CO2與NH3合成尿素和液態水的熱化學方程式_____
。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol,③H2O(l)=H2O(g)△H=+44.0kJ/mol,寫出CO2與NH3合成尿素和液態水的熱化學方程式_____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅、氮元素形成的化合物在各領域有著重要的作用。
(1)基態Zn2+的價電子排布式為_______________;
(2)獨立的NH3分子中,H-N-H鍵鍵角為107°18’。如圖是[Zn(NH3)6]2+的部分結構以及其中H-N-H鍵鍵角。
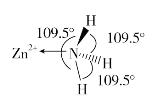
請解釋[Zn(NH3)6]2+離子中H-N-H鍵角變為109.5°的原因是_____________。
(3)離子液體具有很高的應用價值,其中EMIM+離子由H、C、N三種元素組成,其結構如圖所示:
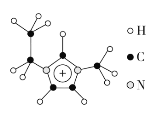
大π鍵可用符號Π![]() 表示,其中m、n分別代表參與形成大π鍵的原子數和電子數。則EMIM+離子中的大π鍵應表示為___________________。化合物[EMIM][AlCl4]具有很高的應用價值,其熔點只有7 ℃,該物質晶體的類型是________。
表示,其中m、n分別代表參與形成大π鍵的原子數和電子數。則EMIM+離子中的大π鍵應表示為___________________。化合物[EMIM][AlCl4]具有很高的應用價值,其熔點只有7 ℃,該物質晶體的類型是________。
(4)過渡元素水合離子是否有顏色與原子結構有關,且存在一定的規律,已知Zn2+等過渡元素離子形成的水合離子的顏色如下表所示:
離子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合離子的顏色 | 無色 | 綠色 | 淺綠色 | 無色 |
請根據原子結構推測Sc3+、Zn2+的水合離子為無色的原因:____________________。
(5)Zn與S形成某種化合物的晶胞如圖所示。
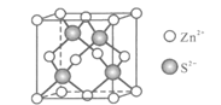
①Zn2+填入S2-組成的________________空隙中;
②由①能否判斷出S2-、Zn2+相切?_________(填“能”或“否”);已知晶體密度為dg/cm3,S2-半徑為a pm,若要使S2-、Zn2+相切,則Zn2+半徑為____________________pm(寫計算表達式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以熔融Li2CO3和K2CO3為電解質,天然氣經重整催化作用提供反應氣的燃料電池如圖。下列說法正確的是
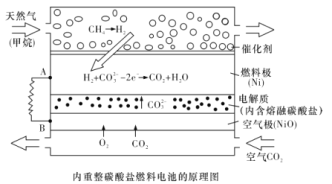
A.以此電池為電源電解飽和食鹽水,當有0.2 mol e-轉移時,陽極產生2.24 L氣體
B.若以甲烷為燃料氣時負極電極反應式:CH4+5O2- - 8e - =CO32- +2H2O
C.該電池使用過程中需補充Li2CO3和K2CO3
D.空氣極發生的電極反應式為O2+4e- +2CO2 =2CO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
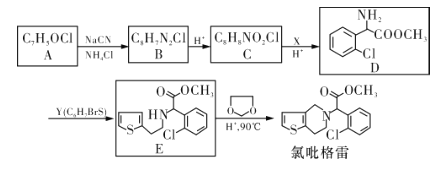
【題目】氯吡格雷(Clopidogrel)是一種用于抑制血小板聚集的藥物。以A為原料合成氯吡格雷的路線如下:
已知: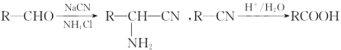 。
。
請回答下列問題:
(1)A中含氧官能團的名稱為___________,C→D的反應類型是_____________。
(2)Y的結構簡式為___________,在一定條件下Y與BrCl(一氯化溴,與鹵素單質性質相似)按物質的量1:1發生加成反應,生成的產物可能有_______種。
(3)C分子間可在一定條件下反應生成含有3個六元環的產物,該反應的化學方程式為_________________________________。
(4)由E轉化為氯吡格雷時,生成的另一種產物的結構簡式為_______________。
(5)寫出A的所有同分異構體(芳香族化合物)的結構簡式:___________________(只有一個環、不考慮立體異構)。
(6)請結合題中信息寫出以![]() 為有機原料制備化合物
為有機原料制備化合物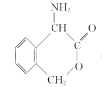 的合成路線流程圖(無機試劑任選)。______________________________________________。合成流程圖示例如下:
的合成路線流程圖(無機試劑任選)。______________________________________________。合成流程圖示例如下:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式的書寫及評價,均合理的是
選項 | 離子方程式 | 評價 |
A | 用銅電極電解飽和KCl溶液:2H2O+2Cl- | 正確:Cl-的失電子能力比OH-強 |
B | 向CuSO4溶液中通入過量的H2S氣體:Cu2++H2S=CuS↓+2H+ | 錯誤:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液與足量的NaOH溶液反應:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 錯誤:Ba2+與HCO3-系數比應為1:2 |
D | 過量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正確:H2SO3的酸性比HClO強 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知25℃時有關弱電解質的電離平衡常數:
弱電解質化學式 | CH3COOH | NH3·H2O | H2CO3 |
電離平衡常數(25℃) | 1.8×10-5 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
在25℃時,下列有關電解質溶液的說法不正確的是
A.pH相等的四種溶液a. CH3COONa b.Na2CO3 c. NaHCO3 d.NaOH,則四種溶液的溶質的物質的量濃度由小到大順序為:d<b<c<a
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.1L 0.50mol·L-1NH4Cl溶液與2L0.25mo·L-1NH4Cl溶液,前者含NH4+物質的量多
D.濃度均為0.1mol·L-1的CH3COOH、CH3 COONa混合溶液中: c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向20mL某濃度的硫酸溶液中滴入0.1mol·L-1氨水,溶液中水電離的氫離子濃度隨加入氨水的體積變化如圖。下列分析不正確的是( )

A.V=20
B.b點所示溶液中:c(NH4+)>2c(SO42-)>c(H+)>c(OH-)
C.d點所溶液中:c(NH4+)+c(OH-)=2c(SO42-)+c(H+)
D.NH3·H2O的電離常數K≈2×10-5
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com