
| A. | 100mL溶液中一定只有0.02molK+ | B. | 溶液中CO${\;}_{3}^{2-}$濃度為0.1mol/L | ||
| C. | 不能確定Cl-是否存在 | D. | Ba2+和Mg2+一定不存在 |
分析 (1)加入AgNO3溶液有沉淀產生,說明溶液中可能存在Cl-、CO32-、SO42-;
(2)0.04mol為氨氣,溶液中一定含有NH4+,并且物質的量為0.04mol;
(3)4.66g為硫酸鋇,6.63g為硫酸鋇和碳酸鋇;再根據電荷守恒,得出一定存在鉀離子.
解答 解:(1)與AgNO3溶液有沉淀產生的離子有Cl-、CO32-、SO42-;(2)加足量NaOH溶液加熱產生氣體,氣體是氨氣,故一定有銨離子0.04mol;
(3)不溶于鹽酸的4.66g為硫酸鋇,物質的量是:$\frac{4.66g}{233g/mol}$=0.02mol;6.63g沉淀是硫酸鋇和碳酸鋇,碳酸鋇質量為6.63g-4.66g=1.97g,碳酸鋇的物質的量為:$\frac{1.97g}{197g/mol}$=0.01mol,故一定存在CO32-、SO42-,因而一定沒有 Mg2+、Ba2+;
根據質量守恒可知:n(CO32-)=n(BaCO3)=0.01 mol,n(SO42-)=n(BaSO4)=0.02mol,
再根據電荷守恒,正電荷為:n(+)=n(NH4+)=0.04mol;c(-)=2c(CO32-)+2c(SO42-)=0.06mol,故一定有K+,至少0.02mol;
綜合以上可以得出,一定存在的離子有NH4+、K+、CO32-、SO42-,一定沒有的離子Mg2+、Ba2+,可能存在Cl-,
A.根據以上推斷,一定存在鉀離子,其物質的量≥0.02mol,故A錯誤;
B.碳酸根離子的物質的量是0.01mol,濃度為:$\frac{0.01mol}{0.1L}$=0.1mol/L,故B正確;
C.不能確定是否含有氯離子,故C正確;
D.溶液中一定沒有的離子Mg2+、Ba2+,故D正確;
故選A.
點評 本題考查常離子的檢驗方法,題目難度中等,明確常見離子的性質及檢驗方法為解答關鍵,利用電荷守恒推斷鉀離子的存在情況為易錯點,試題培養了學生的分析能力及邏輯推理能力.


科目:高中化學 來源: 題型:選擇題
| A. | H2O ( g )═H2 ( g )+$\frac{1}{2}$O2 ( g )△H=+242 kJ/mol | |
| B. | 2H2 ( g )+O2( g )═2H2O ( l )△H=-484 kJ/mol | |
| C. | H2 ( g )+$\frac{1}{2}$O2 ( g )═H2O (g )△H=+242 kJ/mol | |
| D. | 2H2 ( g )+O2 ( g )═2H2O ( g )△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度,KW增大,pH不變仍為中性 | |
| B. | 向水中加入少量硫酸,c(H+)增大 | |
| C. | 向水中加入氨水,平衡向逆反應方向移動,c(OH-)降低 | |
| D. | 一定溫度下,向水中加入少量固體CH3COONa,平衡向正反應方向移動,Kw增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2O+H2O?H3O++OH- | B. | HCO3-+OH-?H2O+CO32- | ||
| C. | CO2+H2O?H2CO3 | D. | CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | FeCl3 | B. | NH4Cl | C. | NaAlO2 | D. | Cu(NO3)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金剛石和石墨均為碳元素組成的單質 | |
| B. | CO2:弱電解質 | |
| C. | 藍礬(CuSO4•5H2O)和干冰屬于化合物,鐵礦石屬于混合物 | |
| D. | 醋酸:一元弱酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 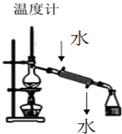 裝置用于分離兩種沸點相差較大的液體互溶混合物 | |
| B. | 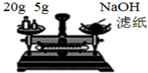 裝置稱量氫氧化鈉固體 | |
| C. | 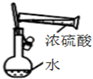 裝置配制一定物質的量濃度的稀硫酸 | |
| D. |  裝置檢查容量瓶是否漏水 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com