
【題目】實驗室采用下圖所示裝置制備乙酸乙酯。實驗結束后,取下盛有飽和碳酸鈉溶液的試管,再沿該試管內壁緩緩加入石蕊溶液1毫升,發現石蕊溶液存在于飽和碳酸鈉溶液層與乙酸乙酯液層之間(整個過程不振蕩試管)。下列有關該實驗的描述不正確的是( )
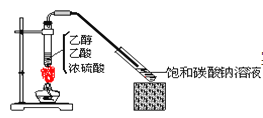
A.制備的乙酸乙酯中混有乙酸和乙醇雜質
B.該實驗中濃硫酸的作用是催化和吸水
C.飽和碳酸鈉溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇和乙酸
D.石蕊層為三層,由上而下是藍、紫、紅
科目:高中化學 來源: 題型:
【題目】某小組同學為研究 NaHCO3 溶液加熱時的 pH 變化及其原因,在 10℃時加熱NaHCO3 溶液,并記錄 pH 如下:
溫度(℃) | 10 | 20 | 30 | 加熱煮沸后冷卻到 50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同學認為,該溶液的 pH 升高的原因是![]() 的水解程度增大,故堿性增強,NaHCO3發生水解反應的離子方程式是______。
的水解程度增大,故堿性增強,NaHCO3發生水解反應的離子方程式是______。
(2)乙同學認為,溶液 pH 升高的原因是NaHCO3 受熱分解,生成了 Na2CO3,并推斷 Na2CO3的水解程度_______________(填“>”或“<”)NaHCO3。
(3)丙、丁同學進行實驗如下:
①丙:向少量加熱煮沸的溶液和未經加熱的溶液中分別加入足量的試劑 X 后,觀察到前者產生大量白色沉淀,因此他認為______ (填“甲”或“乙”)的判斷正確。其中試劑 X 是________(填序號)。
a.Ba(OH)2 溶液 b. BaCl2 溶液 c. NaOH 溶液 d. 澄清石灰水
②丁:將加熱至 30℃的 NaHCO3 溶液恢復至 10℃,測其 pH=8.3。由此可得到的結論是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2是一種國際公認的安全、無毒的綠色消毒劑,沸點11℃,凝固點-59℃。工業上,可用下列原理制備ClO2(液相反應):![]() 。設NA是阿伏伽德羅常數的值。下列說法正確的是( )
。設NA是阿伏伽德羅常數的值。下列說法正確的是( )
A.在標準狀況下,2240mL ClO2含有原子數為0.3NA
B.若生成1.5mol Na2SO4,則反應后的溶液中Fe3+數目為0.2NA
C.48.0g FeS2完全反應,則上述反應中轉移電子數為6NA
D.每消耗30mol NaClO3,生成的水中氫氧鍵數目為14NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室從含碘廢液![]() 含有
含有![]() 、
、![]() 、
、![]() 、
、![]() 等
等![]() 中回收碘,操作過程如下:
中回收碘,操作過程如下:

![]() 向廢液中加入
向廢液中加入![]() 溶液,發生“還原”反應的離子方程式為 ______。
溶液,發生“還原”反應的離子方程式為 ______。
![]() “氧化”操作在三頸燒瓶中進行,將溶液用鹽酸調至pH約為2,緩慢通入
“氧化”操作在三頸燒瓶中進行,將溶液用鹽酸調至pH約為2,緩慢通入![]() 。實驗用水浴控制在
。實驗用水浴控制在![]() 左右的較低溫度下進行的原因是 ______。
左右的較低溫度下進行的原因是 ______。

![]() 某研究小組用圖裝置對
某研究小組用圖裝置對![]() 與KI溶液的反應進行探究,發現通入
與KI溶液的反應進行探究,發現通入![]() 一段時間后,KI溶液變為黃色,繼續通入
一段時間后,KI溶液變為黃色,繼續通入![]() ,則溶液黃色變淺,最后變為無色.研究小組對所得無色溶液中碘元素的存在形態提出了以下假設:
,則溶液黃色變淺,最后變為無色.研究小組對所得無色溶液中碘元素的存在形態提出了以下假設:

假設一:沒有![]() 形態;假設二:沒有
形態;假設二:沒有![]() 形態;假設三:有
形態;假設三:有![]() 形態。
形態。
![]() 請設計實驗證明假設一成立
請設計實驗證明假設一成立![]() 試劑自選
試劑自選![]() 。
。
實驗操作 | 預期現象 | 結論 |
_______ | _______ | 假設一成立 |
![]() 若假設三成立,請寫出生成
若假設三成立,請寫出生成![]() 的離子方程式 ______。
的離子方程式 ______。
![]() 該研究小組還進行了對加碘鹽中
該研究小組還進行了對加碘鹽中![]() 含量測定的如下實驗:
含量測定的如下實驗:
![]() 準確稱取加碘鹽mg于燒杯中,加入適量蒸餾水和過量的KI,再滴入適量的稀硫酸,充分反應,將所得混合液配成
準確稱取加碘鹽mg于燒杯中,加入適量蒸餾水和過量的KI,再滴入適量的稀硫酸,充分反應,將所得混合液配成![]() 待測溶液.移取
待測溶液.移取![]() 待測溶液于錐形瓶中,加幾滴淀粉試液,用c
待測溶液于錐形瓶中,加幾滴淀粉試液,用c![]()
![]() 標準液滴定至終點,重復3次,測得平均值為VmL。
標準液滴定至終點,重復3次,測得平均值為VmL。
已知:![]() ,
,![]() 。測定時,判斷達到滴定終點的現象為 ______ ,由測定數據可求得該樣品中含
。測定時,判斷達到滴定終點的現象為 ______ ,由測定數據可求得該樣品中含![]() 的質量分數為 ______
的質量分數為 ______ ![]() 用含m、c、V的代數式表示,
用含m、c、V的代數式表示,![]()
![]() 。
。
![]() 在滴定操作正確無誤的情況下,用此種測定方法測得的結果往往偏高,其原因是受空氣的影響,請用離子方程式表示產生這一影響的原因 ______。
在滴定操作正確無誤的情況下,用此種測定方法測得的結果往往偏高,其原因是受空氣的影響,請用離子方程式表示產生這一影響的原因 ______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究光盤金屬層含有的Ag(其它金屬微量忽略不計)、丟棄電池中的Ag2O等廢舊資源的回收利用意義重大。下圖為從光盤中提取Ag的工業流程。請回答下列問題。

(1)NaClO溶液在受熱或酸性條件下易分解,“氧化”階段需在80℃條件下進行,適宜的加熱方式為________。
(2)NaClO溶液與Ag反應的產物為AgCl、NaOH和O2,該反應的化學方程式為________。有人提出以HNO3代替NaClO氧化Ag,從反應產物的角度分析,其缺點是________。
(3)操作Ⅰ的名稱為____,簡述利用“操作Ⅰ”的裝置洗滌難溶物的實驗操作________。
(4)化學上常用10%的氨水溶解AgCl固體,AgCl與NH3·H2O按1︰2反應可生成Cl-和一種陽離子________的溶液(填陽離子的化學式)。實際反應中,即使氨水過量也不能將AgCl固體全部溶解,可能的原因是________。
(5)常溫時N2H4·H2O(水合肼)在堿性條件下能還原(4)中生成的陽離子,自身轉化為無害氣體N2,理論上消耗0.1 mol的水合肼可提取到________g的單質Ag。
(6)廢舊電池中Ag2O能將有毒氣體甲醛(HCHO)氧化成CO2,科學家據此原理將上述過程設計為原電池回收電極材料Ag并有效去除毒氣甲醛。則此電池的正極反應式為________,負極的產物有________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與社會生活密切相關,下列說法正確的是( )
A.軍艦船底鑲嵌鋅塊作正極,以防船體被腐蝕
B.汽車尾氣中NO和CO可以緩慢反應生成N2和CO2,減小壓強,反應速率減慢
C.金屬冶煉過程是金屬離子得電子變成金屬單質的氧化過程
D.PM2.5顆粒![]() 微粒直徑約為2.5×106m)分散在空氣中形成氣溶膠
微粒直徑約為2.5×106m)分散在空氣中形成氣溶膠
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某離子反應中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六種微粒,其中
六種微粒,其中![]() 的物質的量隨時間變化的曲線如圖所示。下列判斷正確的是
的物質的量隨時間變化的曲線如圖所示。下列判斷正確的是
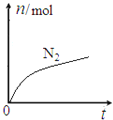
A. 該反應的氧化劑ClO-,還原產物是![]() B. 消耗1mol還原劑,轉移6mol電子
B. 消耗1mol還原劑,轉移6mol電子
C. 水是生成物,且反應后溶液的酸性明顯增強 D. 氧化劑與還原劑的物質的量之比為2:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在某一化學反應中,反應物B的濃度在5s內從2.0mol/L變成0.5mol/L,在這5s 內B的化學反應速率為多少______?
(2)一個5L的容器中,盛入8.0mol某氣體反應物,5min后,測得這種氣體反應物還剩余 6.8mol,這種反應物的化學反應速率為多少_________?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1) 寫出CO2的空間構型:___________。
(2) 寫出Na3N的電子式:____________________。
(3) 寫出C2H6O的化學名稱:______________________。
(4) 寫出乙烯的實驗式:_________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com