
 .
.分析 X是短周期中原子半徑最小的元素,是氫元素,X、Y組成的氣體甲能使濕潤的紅色石蕊試紙變藍,則甲為氨氣,則Y是N元素;
(1)N的原子結構示意圖是 ;
;
(2)氨氣的水溶液與硫酸鋁溶液反應離子方程式3NH3?H20+Al3+=Al(OH)3↓+3NH4+;
(3)氨氣與氯化氫反應生成氯化銨,氯化銨中所含化學鍵類型有銨根離子與氯離子之間形成的離子鍵和氮與氫之間形成的共價鍵;氯化銨是強酸弱堿鹽水解呈酸性,離子濃度大小:不水解的離子>水解的弱離子>顯性離子>隱性離子;
(4)①合成氨的反應是體積減少的反應,所以可以通過增大壓強,加快化學反應的速率,提高氨氣的轉化率;
②(i)平衡常數等于平衡時生成物的濃度冪之積比上反應物濃度冪之積,正反應是放熱反應,溫度越高K值越小;
(ii)依據熱化學方程式和蓋斯定律計算得到所需熱化學方程式.
解答 解:(1)N的原子結構示意圖是 ,故答案為:
,故答案為: ;
;
(2)氨氣的水溶液與硫酸鋁溶液反應離子方程式3NH3?H20+Al3+=Al(OH)3↓+3NH4+,故答案為:3NH3?H20+Al3+=Al(OH)3↓+3NH4+;
(3)氨氣與氯化氫反應生成氯化銨,氯化銨中所含化學鍵類型有銨根離子與氯離子之間形成的離子鍵和氮與氫之間形成的共價鍵;氯化銨是強酸弱堿鹽水解呈酸性,離子濃度大小:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案為:離子鍵和共價鍵;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(4)①合成氨的反應是體積減少的反應,所以可以通過增大壓強,加快化學反應的速率,提高氨氣的轉化率,故答案為:增大壓強;
②平衡常數等于平衡時生成物的濃度冪之積比上反應物濃度冪之積,所以K=$\frac{c[CO(N{H}_{2})_{2}]×c({H}_{2}O)}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$,正反應是放熱反應,溫度越高K值越小,
故答案為:$\frac{c[CO(N{H}_{2})_{2}]×c({H}_{2}O)}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$;減小;
(ii)①2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)△H1=-536.1kJ•mol-1,
②4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-1806.4kJ•mol-1
依據蓋斯定律②-①×2得到CO(NH2)2(g)與NO反應的熱化學方程式2CO(NH2)2(g)+6NO(g)=2CO2(g)+5N2(g)+4H2O(g)△H=-734.2 kJ/mol;
故答案為:2CO(NH2)2(g)+6NO(g)=2CO2(g)+5N2(g)+4H2O(g)△H=-734.2 kJ/mol.
點評 本題考查了原子結構、離子方程的書寫,化學平衡、反應速率影響因素分析,化學平衡常數表達式,掌握基礎是關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
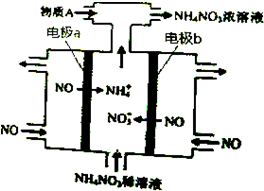
| A. | b極的電極反應為:NO-3e-+2H2O=NO3-+4H+ | |
| B. | 溶液中的H+由電極a處向電極b處遷移 | |
| C. | 電解過程總反應的化學方程式為:8NO+7H2O$\frac{\underline{\;通電\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 為使電解產物全部轉化為NH4NO3,需補充的物質A是NH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.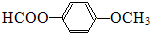 、
、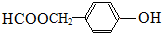 或
或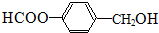 (任寫一種).
(任寫一種).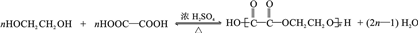 .
.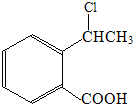 為原料制
為原料制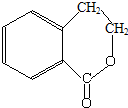 的合成路線流程圖(無機試劑任用),在方框中填出相應的物質,并在括號注明反應條件.合成路線流程圖示例如圖2:
的合成路線流程圖(無機試劑任用),在方框中填出相應的物質,并在括號注明反應條件.合成路線流程圖示例如圖2:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
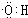 ,D中官能團的名稱為羧基.
,D中官能團的名稱為羧基.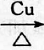 2CH3CHO+2H2O.
2CH3CHO+2H2O. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
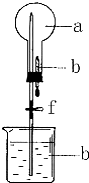 如圖的裝置中,干燥燒瓶中盛有某種氣體,燒杯和滴管內盛放某種溶液.擠壓滴管的膠頭,下列與試驗事實不相符的是( )
如圖的裝置中,干燥燒瓶中盛有某種氣體,燒杯和滴管內盛放某種溶液.擠壓滴管的膠頭,下列與試驗事實不相符的是( )| A. | CO2(NaHCO3溶液)無色噴泉 | B. | NH3(H2O含酚酞)紅色噴泉 | ||
| C. | Cl2(NaOH溶液)無色噴泉 | D. | HCl(AgNO3溶液)白色噴泉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 材料 | 主要化學成分 | |
| A | 大理石、石灰石 | CaCO3 |
| B | 剛玉、金剛石 | Al2O3 |
| C | 普通水泥、普通玻璃 | 硅酸鹽 |
| D | 沙子、石英 | SiO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 L二氯甲烷的分子數約為NA個 | |
| B. | 盛有SO2的密閉容器中含有NA個氧原子,則SO2的物質的量為0.5 mol | |
| C. | 17.6 g丙烷中所含的極性共價鍵為6.4 NA個 | |
| D. | 電解精煉銅時,若陰極得到的電子數為2 NA個,則陽極質量減少64 g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
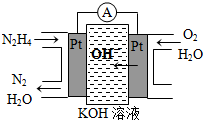 肼(N2H4)又稱聯氨,廣泛用于火箭推進劑、有機合成及燃料電池,NO2的二聚體N2O4則是火箭中常用氧化劑.試回答下列問題
肼(N2H4)又稱聯氨,廣泛用于火箭推進劑、有機合成及燃料電池,NO2的二聚體N2O4則是火箭中常用氧化劑.試回答下列問題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com