
已知:電離度可以表示弱電解質的電離程度,它表示已電離的弱電解質的物質的量占弱電解質總物質的量的百分數。在室溫條件下:
(1)設某pH值的硫酸溶液中水的電離度為α1,相同pH值的硫酸鋁溶液中水的電離度為α2,相比較α1 ______α2 (填<、>或=)。
(2)若硫酸和硫酸鋁兩種溶液的pH值都是3,那么硫酸中水電離出的c(H+)是硫酸鋁溶液中水電離出的c(H+)的________倍。
 名校聯盟快樂課堂系列答案
名校聯盟快樂課堂系列答案科目:高中化學 來源: 題型:
| 酸或堿 | 電離平衡常數(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×1010 |
| HClO | 3×10-8 |
| NH2?H2O | 1.8×10-5 |
| 難(微)溶物 | 深度積常數(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
查看答案和解析>>
科目:高中化學 來源:2012屆河北省石家莊市高三補充題、壓軸題化學試卷(帶解析) 題型:填空題
(14分)氫氟酸(HF)是一元弱酸,在水溶液中的電離方程式為:HF H++F-。25℃下,向20mL0.2mol?L-1的氫氟酸中滴加0.2mol?L-1的NaOH溶液時,溶液的pH變化如圖所示。
H++F-。25℃下,向20mL0.2mol?L-1的氫氟酸中滴加0.2mol?L-1的NaOH溶液時,溶液的pH變化如圖所示。
已知:電離度( )和電離平衡常數(K)一樣,可以用來衡量弱電解質在稀溶液中的電離能力,
)和電離平衡常數(K)一樣,可以用來衡量弱電解質在稀溶液中的電離能力, 。
。
請回答下列問題:
(1)在氫氟酸的稀溶液中,通過改變以下條件能使氫氟酸的電離度[ (HF)]增大的是_______,可使氫氟酸的電離平衡常數[Ka(HF)] 增大的是_______。
(HF)]增大的是_______,可使氫氟酸的電離平衡常數[Ka(HF)] 增大的是_______。
a.升高溫度 b.向溶液中滴入2滴濃鹽酸 c.加入少量NaF固體 d.加水稀釋
(2)在此溫度下,氫氟酸的電離平衡常數Ka(HF)為:__ (保留兩位有效數字),電離度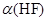 約為___ _%。
約為___ _%。
(3)已知在此溫度下:
H+(aq)+OH-(aq)=H2O(1) △H=-a kJ?mol -1;
HF(aq)  H+(aq)+F-(aq) △H=+b kJ?mol -1
H+(aq)+F-(aq) △H=+b kJ?mol -1
則該過程中和反應的熱化學方程式為:________________________________ ;在忽略F-水解的情況下,反應達到B點時,滴加過程中所釋放的熱量為________kJ(用只含a、b的式子表示)。
(4)下列有關圖中各點微粒濃度關系正確的是_______________。
a.在A處溶液中:c(F—)+c(HF)="0.2" mol?L-1
b.在B處溶液中:c(H+)+c(HF)= c(OH—)
c.在B處溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B處溶液中都符合: = Ka(HF)
= Ka(HF)
查看答案和解析>>
科目:高中化學 來源:2011-2012學年河北省石家莊市高三補充題、壓軸題化學試卷(解析版) 題型:填空題
(14分)氫氟酸(HF)是一元弱酸,在水溶液中的電離方程式為:HF H++F-。25℃下,向20mL0.2mol•L-1的氫氟酸中滴加0.2mol•L-1的NaOH溶液時,溶液的pH變化如圖所示。
H++F-。25℃下,向20mL0.2mol•L-1的氫氟酸中滴加0.2mol•L-1的NaOH溶液時,溶液的pH變化如圖所示。

已知:電離度( )和電離平衡常數(K)一樣,可以用來衡量弱電解質在稀溶液中的電離能力,
)和電離平衡常數(K)一樣,可以用來衡量弱電解質在稀溶液中的電離能力, 。
。
請回答下列問題:
(1)在氫氟酸的稀溶液中,通過改變以下條件能使氫氟酸的電離度[ (HF)]增大的是_______,可使氫氟酸的電離平衡常數[Ka(HF)] 增大的是_______。
(HF)]增大的是_______,可使氫氟酸的電離平衡常數[Ka(HF)] 增大的是_______。
a.升高溫度 b.向溶液中滴入2滴濃鹽酸 c.加入少量NaF固體 d.加水稀釋
(2)在此溫度下,氫氟酸的電離平衡常數Ka(HF)為:__
(保留兩位有效數字),電離度 約為___
_%。
約為___
_%。
(3)已知在此溫度下:
H+(aq)+OH-(aq)=H2O(1) △H=-a kJ•mol -1;
HF(aq)  H+(aq)+F-(aq) △H=+b kJ•mol -1
H+(aq)+F-(aq) △H=+b kJ•mol -1
則該過程中和反應的熱化學方程式為:________________________________ ;在忽略F-水解的情況下,反應達到B點時,滴加過程中所釋放的熱量為________kJ(用只含a、b的式子表示)。
(4)下列有關圖中各點微粒濃度關系正確的是_______________。
a.在A處溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B處溶液中:c(H+)+c(HF)= c(OH—)
c.在B處溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B處溶液中都符合: = Ka(HF)
= Ka(HF)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com