
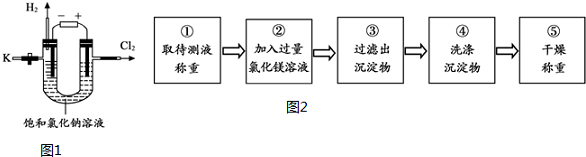
分析 【探究一】根據氫氧化鈉能使酚酞試液變紅色分析回答;
【探究二】查閱資料:氫氧化鈉與氯化鎂的反應生成氫氧化鎂和氯化鈉;
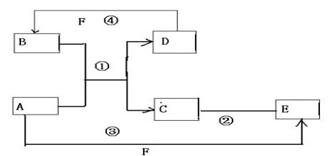
(1)氯化鎂能與氫氧化鈉反應,過量氯化鎂溶液能將氫氧化鈉全部反應掉,根據溶液中是否有過量的鎂離子判斷所加氯化鎂溶液是否過量;
(2)利用沉淀物的質量計算氫氧化鈉的質量分數時,若不洗滌沉淀,那么沉淀上會附著一些雜質,從而使沉淀的質量增大,會導致計算出的氫氧化鈉質量偏大,使所測定氫氧化鈉的質量分數偏大.
解答 解:【探究一】由于氫氧化鈉溶液能使酚酞試液變紅色,所以檢驗含有氫氧化鈉的方法是:取樣,滴加無色酚酞溶液,溶液變紅色,
故答案為:取樣,滴加無色酚酞溶液,溶液變紅色;
【探究二】
查閱資料:
Ⅱ.氫氧化鈉與氯化鎂溶液能發生復分解反應生成了氫氧化鎂沉淀和氯化鈉,化學方程式為:2NaOH+MgCl2=Mg(OH)2↓+2NaCl,
故答案為:2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(1)由于氫氧化鈉與氯化鎂溶液能發生反應生成了氫氧化鎂沉淀和氯化鈉,所以,步驟②加入的氯化鎂溶液必需過量,其目的是使NaOH完全反應.實驗過程中,判斷所加氯化鎂溶液是否過量的方法是:取步驟②上層清液于試管中,滴加氫氧化鈉溶液,若有白色沉淀生成,則所加氯化鎂溶液過量,反之,則不過量,
故答案為:使NaOH完全反應;取步驟②上層清液于試管中,滴加氫氧化鈉溶液,若有白色沉淀生成,則所加氯化鎂溶液過量,反之,則不過量;
(2)利用沉淀物的質量計算氫氧化鈉的質量分數,若缺少步驟④的操作,沉淀中因含有其他雜質而質量偏大,所測定氫氧化鈉的質量分數將偏大,
故答為:偏大.
點評 本題考查了物質的制備、提純等實驗基本操作,難度不大,注意元素化合物質知識與實驗基本操作的靈活運用,本題對學生的分析問題解決問題的能力有一定的要求.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鐵是目前人類使用量最大的金屬,它能形成多種化合物.
鐵是目前人類使用量最大的金屬,它能形成多種化合物.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
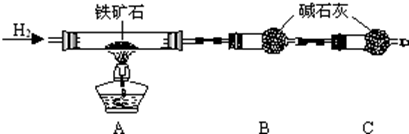
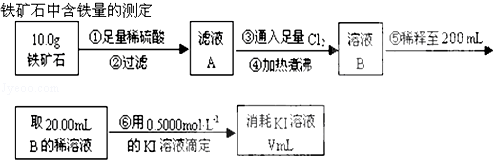
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
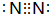 反應?①的化學方程式2NH3+3Cl2=N2+6HCl
反應?①的化學方程式2NH3+3Cl2=N2+6HCl查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
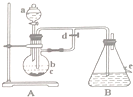 如圖所示裝置,可用來制取和觀察Fe(OH)2在空氣中被氧化的顏色變化.實驗時必須使用鐵屑和6mol/L的硫酸,其他試劑任選.填寫下列空白:
如圖所示裝置,可用來制取和觀察Fe(OH)2在空氣中被氧化的顏色變化.實驗時必須使用鐵屑和6mol/L的硫酸,其他試劑任選.填寫下列空白:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化硫氣體通入過氧化鈉:2SO2+2Na2O2═2Na2SO3+O2↑ | |
| B. | 金屬鋁投入NaOH溶液中:Al+2OH-═AlO${\;}_{2}^{-}$+H2↑ | |
| C. | 硫酸亞鐵與酸性高錳酸鉀反應:3Fe2++MnO${\;}_{4}^{+}$+4H+=3Fe3++MnO2↓+2H2O | |
| D. | 碳酸氫鈉溶液與少量石灰水反應:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com