【答案】
分析:(1)有效“減碳”的手段之一是節能,利用太陽光催化分解水制氫最節能;
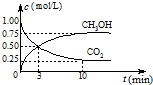
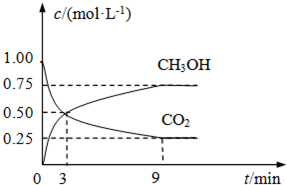
(2)①從3min到9min,CO
2的濃度由0.5mol/L降低為0.25mol/L,根據v=
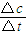
計算v(CO
2),再根據速率之比等于化學計量數之比計算v(H
2);
②A.圖中交叉點之后反應中CO
2與CH
3OH的物質的量濃度還在發生變化;
B.都為氣體,容器的體積不變,混合氣體的總質量不變,密度自始至終為定值;
C.單位時間內消耗3mol H
2,同時生成1mol H
2O,都表示正反應速率;
D.可逆反應得到平衡,反應混合物的濃度、含量為定值;
(3)A、由表中數據可知,溫度越高平衡常數越小,可逆反應向逆反應移動,升高溫度平衡向吸熱反應移動;
B、根據△G=△H-T△S判斷,△G>0,反應不能自發進行;△G<0,反應自發進行;
C、利用三段式計算出平衡時平衡混合物各組分的濃度,代入平衡常數的表達式計算;
D、由表中數據可知,溫度越高平衡常數越小,可逆反應向逆反應移動,不利用原料氣轉化.
解答:解:(1)有效“減碳”的手段之一是節能,利用太陽光催化分解水制氫最節能,不需要使用熱量與電能,故選:C;
(2)①由圖可知,從3min到9min,CO
2的濃度由0.5mol/L降低為0.25mol/L,所以v(CO
2)=
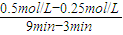
=
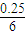
mol/(L?min),速率之比等于化學計量數之比,所以v(H
2)=3v(CO
2)=3×
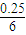
mol/(L?min)=0.125mol/(L?min),故答案為:0.125;
②A.圖中交叉點之后反應中CO
2與CH
3OH的物質的量濃度還在發生變化,反應為達平衡,故A錯誤;
B.都為氣體,容器的體積不變,混合氣體的總質量不變,密度自始至終為定值,不能說明可逆反應到達平衡,故B錯誤;
C.單位時間內消耗3mol H
2,同時生成1mol H
2O,都表示正反應速率,自始至終都按3:1進行,不能說明到達平衡,故C錯誤;
D.隨反應進行CO
2的體積分數減小,當CO
2的體積分數在混合氣體中保持不變,說明可逆反應到達平衡狀態,故D正確.
故選:D;
(3)A、由表中數據可知,溫度越高平衡常數越小,可逆反應向逆反應移動,升高溫度平衡向吸熱反應移動,故正反應為放熱反應,故A正確;
B、反應為放熱反應△H<0,△G=△H-T△S<0,反應自發進行,△S<0,低溫下,反應也可以自發進行,故B錯誤;
C、對于可逆反應:CO(g)+2H
2(g)?CH
3OH(g)
開始(mol/L):0.1 0.2 0
變化(mol/L):0.05 0.1 0.05
平衡(mol/L):0.05 0.1 0.05
所以平衡常數k=
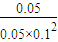
=100,故C正確;
D、增大壓強,平衡向正反應移動,有利于原料氣轉化.由表中數據可知,溫度越高平衡常數越小,可逆反應向逆反應移動,故升高不利用原料氣轉化,采取250℃溫度,考慮反應速率與催化劑的活性,故D錯誤.
故選:AC.
點評:本題考查平衡狀態的判斷、平衡移動、平衡圖象、反應速率計算、平衡常數、反應方向判斷等,難度不大,注重基礎知識的考查,注意基礎知識的掌握.

 2H2↑+O2↑
2H2↑+O2↑ 2H2↑+O2↑
2H2↑+O2↑ 2H2↑+O2↑
2H2↑+O2↑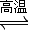 CO+3H2
CO+3H2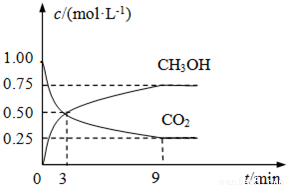
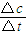 計算v(CO2),再根據速率之比等于化學計量數之比計算v(H2);
計算v(CO2),再根據速率之比等于化學計量數之比計算v(H2);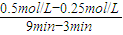 =
=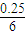 mol/(L?min),速率之比等于化學計量數之比,所以v(H2)=3v(CO2)=3×
mol/(L?min),速率之比等于化學計量數之比,所以v(H2)=3v(CO2)=3×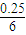 mol/(L?min)=0.125mol/(L?min),故答案為:0.125;
mol/(L?min)=0.125mol/(L?min),故答案為:0.125;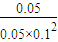 =100,故C正確;
=100,故C正確;