

| n(CO):n(H2O) | CO轉化率 | H2O轉化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
| 生成物平衡濃度冪之積 |
| 反應物平衡濃度冪之積 |
| △n |
| n |
| 1 |
| 2 |
| 1 |
| 2 |
| C(CO2)?C(H2) |
| C(CO)?C(H2O) |
| C(CO2)?C(H2) |
| C(CO)?C(H2O) |
| 生成物濃度的冪之積 |
| 反應物濃度的冪之積 |
| C(CO2)?C(H2) |
| C(CO)?C(H2O) |
| △n |
| n |
| 生成物平衡濃度冪之積 |
| 反應物平衡濃度冪之積 |
| Xmol/L × Xmol/L |
| (1-X)mol/L × (4-X)mol/L |
| 0.8mo/L |
| 1mol/L |


 好成績1加1期末沖刺100分系列答案
好成績1加1期末沖刺100分系列答案 金狀元績優好卷系列答案
金狀元績優好卷系列答案科目:高中化學 來源: 題型:
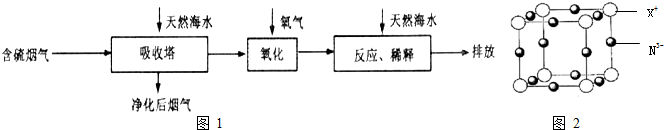
| 難溶電解質 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 (4)
(4) (5)CH3Cl
(5)CH3Cl  (7)CH3COOH (8)CH3CHO (9)CH3COOC2H5 (10)CH3OCH3
(7)CH3COOH (8)CH3CHO (9)CH3COOC2H5 (10)CH3OCH3查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、.萃取、分液、蒸餾 |
| B、分液、萃取、蒸餾 |
| C、萃取、蒸餾、分液 |
| D、蒸餾、分液、萃取 |
查看答案和解析>>
科目:高中化學 來源: 題型:
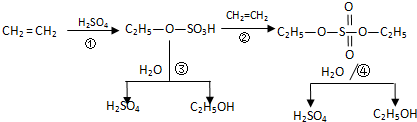
| A、該過程中③、④是酯類的水解反應 |
| B、該過程中硫酸是催化劑 |
| C、該過程中①、②是加成反應 |
| D、該過程是一種新的硫酸生產方法 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com