
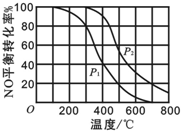
 (1)汽車尾氣是造成空氣污染產生霧霾的原因之一.其中涉及的反應2NO(g)+O2?2NO2(g)在其他條件不變達平衡時.分別測得NO的平衡轉化率在不同壓強(P1、P2)下溫度變化的曲線如圖所示.
(1)汽車尾氣是造成空氣污染產生霧霾的原因之一.其中涉及的反應2NO(g)+O2?2NO2(g)在其他條件不變達平衡時.分別測得NO的平衡轉化率在不同壓強(P1、P2)下溫度變化的曲線如圖所示.分析 (1)①已知2NO(g)+O2(g)?2N02(g)是正方向體積減小的反應,根據壓強對平衡的影響分析;
②根據圖象2判斷該反應正方向是放熱還是吸熱,再判斷K隨溫度的變化;
(2)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),
②2NO(g)+Cl2(g)?2ClNO(g),
根據蓋斯定律①×2-②可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),則該反應平衡常數為①的平衡常數平方與②的商;
②測得10min內v(ClNO)=7.5×10-3mol•L-1•min-1,則△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,由方程式計算參加反應NO、氯氣的物質的量,進而計算平衡時氯氣的物質的量、NO的轉化率;
正反應為氣體物質的量減小的反應,恒溫恒容下條件下,到達平衡時壓強比起始壓強小,其他條件保持不變,反應(Ⅱ)在恒壓條件下進行,等效為在恒溫恒容下的平衡基礎上增大壓強,平衡正向移動;
平衡常數只受溫度影響,溫度不變,平衡常數不變.
解答 解:(1)①已知2NO(g)+O2(g)?2N02(g)是正方向體積減小的反應,增大壓強平衡正移,則NO的轉化率會增大,由圖可知p2時NO的轉化率大,則p2時壓強大,即p1<p2;故答案為:p1<p2;
②由圖象2可知,隨著溫度的升高,NO的轉化率減小,說明升高溫度平衡逆移,則該反應正方向是放熱反應,所以升高溫度平衡常數K減小;故答案為:減小;
(2)2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1 △H<0 (I)
2NO(g)+Cl2(g)?2ClNO(g) K2 △H<0 (II)
根據蓋斯定律,Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),則該反應平衡常數K=$\frac{{K}_{1}^{2}}{{K}_{2}}$,故答案為:$\frac{{K}_{1}^{2}}{{K}_{2}}$;
②測得10min內v(ClNO)=7.5×10-3mol•L-1•min-1,則△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,
由方程式可知,參加反應氯氣的物質的量為0.15mol×$\frac{1}{2}$=0.075mol,故平衡時氯氣的物質的量為0.1mol-0.075mol=0.025mol;
參加反應NO物質的量為0.15mol,則NO的轉化率為$\frac{0.15mol}{0.2mol}$×100%=75%;
正反應為氣體物質的量減小的反應,恒溫恒容下條件下,到達平衡時壓強比起始壓強小,其他條件保持不變,反應(Ⅱ)在恒壓條件下進行,等效為在恒溫恒容下的平衡基礎上增大壓強,平衡正向移動,NO轉化率增大,故轉化率α2>α1;
平衡常數只受溫度影響,溫度不變,平衡常數不變,即平衡常數K2 不變,正反應是放熱反應可以升高溫度使K2減小,
故答案為:0.025;75%;>;不變;升高溫度.
點評 本題考查化學平衡計算與影響因素、化學平衡常數等,側重考查學生分析計算能力,需要學生具備扎實的基礎與靈活應用能力,難度中等.


 陽光試卷單元測試卷系列答案
陽光試卷單元測試卷系列答案科目:高中化學 來源: 題型:選擇題
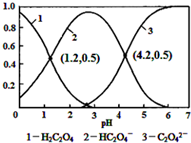
| A. | pH=1.2溶液中:c(K+)+c(H+)═c(OH-)+c(H2C2O4) | |
| B. | pH=2.7溶液中:$\frac{{c}^{2}(H{C}_{2}{O}_{4}^{-})}{c({H}_{2}{C}_{2}{O}_{4})}$×c(C2O42-)=1000 | |
| C. | 將相同物質的量KHC2O4和K2C2O4固體完全溶于水所得混合液的pH為4.2 | |
| D. | 向pH=1.2的溶液中加KOH溶液將pH增大至4.2的過程中水的電離度一定增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

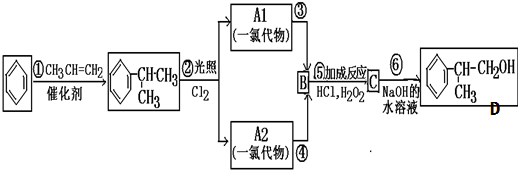
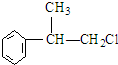 ,
,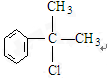
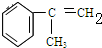 C的結構簡式:
C的結構簡式: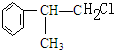 .
.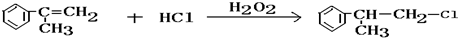 .
.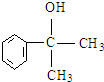 等.
等.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
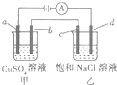 如圖所示,a,b,c均為石墨電極,d為碳鋼電極,通電電解一段時間,假設在電解過程中產生的氣體全部逸出,下列說法正確的是( )
如圖所示,a,b,c均為石墨電極,d為碳鋼電極,通電電解一段時間,假設在電解過程中產生的氣體全部逸出,下列說法正確的是( )| A. | 甲、乙兩燒杯中溶液的pH均保持不變 | |
| B. | 甲燒杯中b電極反應式為:Cu2++2e-═Cu | |
| C. | 當電解一段時間后,將甲、乙兩溶液混合,一定會產生藍色沉淀 | |
| D. | 當b極增重3.2g時,d極產生的氣體為0.56L(標準狀況) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com