
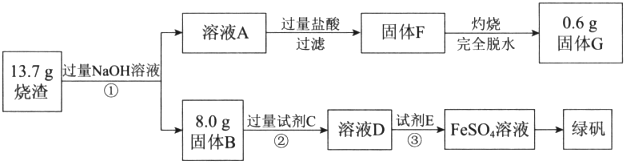
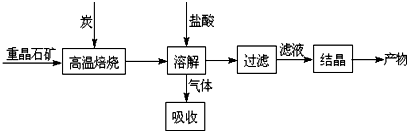
分析 燒渣主要成份為Fe2O3、Al2O3和SiO2,不考慮其他雜質,與過量NaOH溶液混合,離子反應方程式為SiO2+2OH-=SiO32-+H2O、Al2O3+2OH-=2AlO2-+H2O;Fe2O3和NaOH不反應,然后過濾得到的固體B為Fe2O3為8.0g,溶液A中含有Na+、AlO2-、SiO32-和OH-,加入過量鹽酸,發生的反應為離子反應方程式為OH-+H+=H2O、AlO2-+4H+=Al3++2H2O、SiO32-+2H+=H2SiO3↓,然后過濾得到的固體F為H2SiO3↓,灼燒脫水得SiO2為0.6g;固體B為Fe2O3為加過量試劑C溶解,因為要制備FeSO4•7H2O,所以試劑C為稀硫酸,發生反應為:Fe2O3+6H+=2Fe3++3H2O,所得溶液D為硫酸鐵和過量稀硫酸的混合溶液,再加試劑E將三價鐵還原成二價鐵,所以試劑E為鐵單質,反應的離子方程式是Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,最后將硫酸亞鐵溶液進行蒸發濃縮、冷卻結晶、過濾得到綠礬,據此分析.
解答 解:(1)通過以上分析知,溶液A中含有的陰離子主要有AlO2-、SiO32-和OH-,故答案為:OH-;
(2)通過以上分析知,試劑C是稀硫酸,故答案為:稀硫酸;
(3)通過以上分析知,③中反應的離子方程式是Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,故答案為:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑;
(4)通過以上分析知,SiO2為0.6g,Fe2O3為8.0g,所以Al2O3為13.7-8.0-0.6=5.1g,則燒渣中Fe2O3、Al2O3和SiO2的物質的量之比是$\frac{8.0}{160}$:$\frac{5.1}{102}$:$\frac{0.6}{60}$=5:5:1,故答案為:5:5:1.
點評 本題考查物質制備,為高頻考點,側重考查學生分析推斷及綜合應用能力,明確流程圖中發生的反應及物質分離提純方法是解本題關鍵,難度不大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 苯甲酸乙酯(C9H10O2)有水果氣味,用于配制香水香精和人造精油,大量用于食品工業中,其制備步驟如下:
苯甲酸乙酯(C9H10O2)有水果氣味,用于配制香水香精和人造精油,大量用于食品工業中,其制備步驟如下: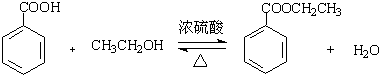 .
.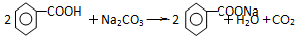 .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
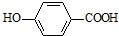 +CH2OH5$\stackrel{催化劑}{→}$
+CH2OH5$\stackrel{催化劑}{→}$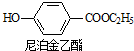 +H2O
+H2O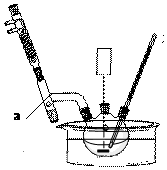
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4個C-H鍵的長度相等 | B. | 4個C-H鍵的強度相同 | ||
| C. | 4個C-H鍵的夾角相同 | D. | 4個C-H連接成正方形 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com