
 短周期元素A、B、C、D在周期表中的位置如圖,E2+與D的簡單陰離子有相同的電子層結構,回答下列問題:
短周期元素A、B、C、D在周期表中的位置如圖,E2+與D的簡單陰離子有相同的電子層結構,回答下列問題: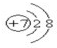 ,元素D位于元素周期表的第ⅥA族.
,元素D位于元素周期表的第ⅥA族.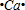 +2
+2 →
→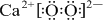 .
.分析 (1)設出B的原子序數,根據四種元素的相對位置得出四種元素的原子序數之和,然后判斷m;
(2)根據D元素原子的次外層電子數等于其他層電子數之和可知D為S,則B為O、A為N、C為F元素,
①N原子形成的簡單離子是N3-,其核電荷數為7,核外電子總數為10,據此寫出該離子結構示意圖;D為S,位于周期表中第三周期ⅥA族;
②A為N,6個原子的氫化物為N2H4,其結構簡式為H2N-NH2;計算出1molN2H4完全燃燒放出熱量,然后寫出該反應的燃燒熱的熱化學方程式;
③C單質為F2,B的氫化物為H2O,寫出氟氣與水反應的化學方程式;
④E2+與D的簡單陰離子有相同的電子層結構,則E為Ca元素,EB2為CaO2,屬于離子化合物,用電子式表示出其形成過程;
⑤根據信息NF3與水反應為:NF3+2H2O=HNO2+3HF,亞硝酸、氟化氫與氫氧化鈉反應生成氟化鈉、亞硝酸鈉和水,據此寫出反應的化學方程式.
解答 解:(1)根據A、B、C、D四種元素在周期表的相對位置可知,D只能位于周期表第三周期,設B的原子序數為x,則原子序數A:x-1、C:x+1、D:x+8,A、B、C、D四種元素的原子序數之和為:(x-1)+x+(x+1)+(x+8)=4x+8,則m必為偶數,故B正確,
故答案為:B;
(2)根據D元素原子的次外層電子數等于其他層電子數之和可知D為S,則B為O、A為N、C為F元素,
①A為N元素,N原子形成的簡單離子是N3-,其核電荷數為7,最外層達到8單質穩定結構,氮離子結構示意圖為: ;D為S元素,位于周期表中VIA族,
;D為S元素,位于周期表中VIA族,
故答案為: ;VIA;
;VIA;
②A為N,6個原子的氫化物為N2H4,為共價化合物,其結構簡式為:H2N-NH2;
常壓298K時0.2mol該氣態氫化物在O2 中完全燃燒,生成氣態A單質和水,放出熱量106.8kJ,1mol該氣體氫化物放出熱量為:106.8kJ×$\frac{1mol}{0.2mol}$=534kJ,則該氣態氫化物燃燒熱的熱化學方程式為:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-534kJ/mol,
故答案為:H2N-NH2; N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-534kJ/mol;
③C單質為F2,B的氫化物為H2O,氟氣與水反應的化學方程式為:2H2O+2F2=4HF+O2,
故答案為:2H2O+2F2=4HF+O2;
④E2+與D的簡單陰離子有相同的電子層結構,則E為Ca元素,EB2為CaO2,屬于離子化合物,用電子式表示出其形成過程為: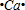 +2
+2 →
→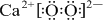 ,
,
故答案為: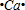 +2
+2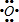 →
→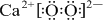 ;
;
⑤NF3與水反應為NF3+2H2O=HNO2+3HF,則和NaOH溶液發生反應為:NF3+4NaOH=NaNO2+3NaF+2H2O,
故答案為:NF3+4NaOH=NaNO2+3NaF+2H2O.
點評 本題考查了位置、結構與性質關系的應用,題目難度中等,涉及元素推斷、電子式、化學方程式、熱化學方程式的書寫等知識,注意掌握元素周期表結構、元素周期律內容,試題側重考查學生的分析、理解能力及靈活應用能力.


科目:高中化學 來源: 題型:選擇題
| A. | ②>⑤>③>④>① | B. | ⑤>②>④>①>③ | C. | ②>⑤>④>③>① | D. | ②>③>⑤>①>④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 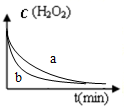 圖表示雙氧水分解時反應物濃度隨時間的變化情況,a為加入少量FeCl3時的變化情況 | |
| B. | 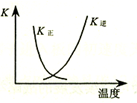 圖中曲線表示反應2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反應的平衡常數K隨溫度的變化 | |
| C. | 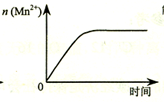 圖表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液與過量的0.1 mol•L-1 H2C2O4溶液混合時,n(Mn2+) 隨時間的變化 | |
| D. | 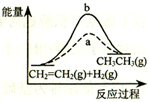 圖中a、b曲線分別表示反應CH2=CH2 (g)+H2(g)→CH3CH3(g);△H>0反應過程中的能量變化,a為不加催化劑時的過程 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4LCH4和CH2C12的混合物所含分子數為NA | |
| B. | 用含0.2mo1 FeC13的飽和溶液制得膠體,其中所含氫氧化鐵膠粒的數目為0.2 NA | |
| C. | 由NO2和CO2組成的混合氣體中共有NA個分子,其中氧元素的質量一定為32g | |
| D. | 2LpH=1的HA酸溶液與足量鋅粒反應,生成H2的分子數一定為0.1 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
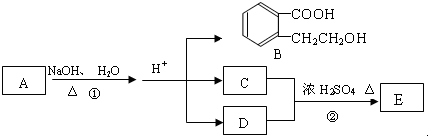
 .(不用寫條件)
.(不用寫條件)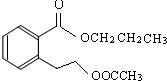 .
.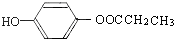 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | Al | Al2O3 | Fe | Fe2O3 |
| 熔點/℃ | 660 | 2054 | 1535 | 1462 |
| 沸點/℃ | 2467 | 2980 | 2750 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| B | D | |
| E |


查看答案和解析>>
科目:高中化學 來源: 題型:多選題
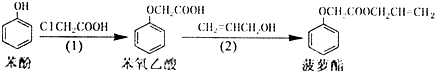
| A. | 步驟(1)、(2)的反應類型不同 | |
| B. | 步驟(1)產物中殘留的苯酚可用FeCl3溶液檢驗 | |
| C. | 苯氧乙酸和菠蘿酯均可與NaOH溶液發生反應 | |
| D. | 步驟(2)產物中殘留的烯丙醇可用溴水檢驗 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com