
【題目】有下列有機物:
① CH2=CH2 ②![]()
③ CH3CH(OH)CH2CH3 ④ (CH3)2C=CH2
⑤ CH3CH2OCH2CH3 ⑥ CH3CH=CHCH=CHCOOH
(1)屬于羧酸的是_____(填序號)。
(2)與③互為同分異構體的是_____(填序號)。
(3)與①互為同系物的是_____(填序號)。
(4)用系統命名法給④命名,其名稱為_____。
科目:高中化學 來源: 題型:
【題目】化合物A相對分子質量為136,分子式為C8H8O2。A的核磁共振氫譜有4個峰且面積之比為1∶2∶2∶3,A分子中只含一個苯環且苯環上只有一個取代基,其紅外光譜與核磁共振氫譜如下圖。關于A的下列說法中,正確的是( )
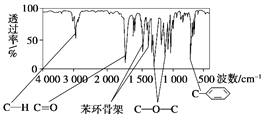
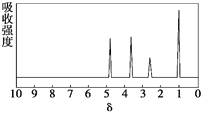
A. 符合題中A分子結構特征的有機物只有1種
B. A屬于酯類化合物,在酸性條件下水解產物遇FeCl3溶液顯紫色
C. A在一定條件下可與4 mol H2發生加成反應
D. 與A屬于同類化合物的同分異構體只有2種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫、鈷及其相關化合物用途非常廣泛。回答下列問題:
(1)基態Co原子價電子軌道排布式為________,第四電離能I4(Co)<I4(Fe),其原因是_______;Co與Ca同周期且最外層電子數相同,單質鈷的熔沸點均比鈣大,其原因是_______.
(2)單質硫與熟石灰加熱產物之一為CaS3,S32-的幾何形狀是_______,中心原子雜化方式是_______,與其互為等電子體的分子是_______ (舉1例)。
(3)K和Na位于同主族,K2S的熔點為840℃,Na2S的熔點為950℃,前者熔點較低的原因是_______ 。
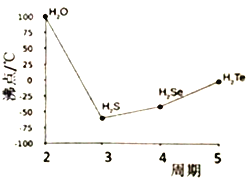
(4)S與O、Se、Te位于同一主族,它們的氫化物的沸點如右圖所示,沸點按圖像所示變為的原因是_______ 。
(5)鈷的一種化合物晶胞結構如下圖所示。

①已知A點的原子坐標參數為為(0,0,0),B點為(![]() ,0,
,0,![]() ),則C點的原子坐標參數為_____。
),則C點的原子坐標參數為_____。
②已知晶胞參數為a=0.5485nm,則該晶體的密度為_____g/cm3(列出計算表達式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 阿伏加德羅常數是12g碳中所含有的碳原子數
B. 已知微粒個數,可通過阿伏加德羅常數計算出微粒的物質的量
C. 阿伏加德羅常數的數值是6.02×1023
D. 阿伏加德羅常數的符號為NA,通常用6.02×1023表示
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學在總結元素化合物性質的過程中,發現化學反應無非是與以下幾類物質的反應,并發現同一物質類別具有一定的通性。

(1)若A由短周期金屬元素組成,其最外層電子數比電子層數少2。
①組成A的元素在周期表中的位置是_______。
②下列說法正確的是_______(填字母)。
a. A的金屬性在短周期元素中最強
b. F可能使酚酞溶液變紅
c. A能從D溶液中置換出活潑性較弱的金屬單質
(2)若A在通常情況下為黃綠色氣體。
①若B為一種金屬單質,則A與B反應的方程式為_______。(任舉一例)
②若C為NaOH溶液,則與0.5 mol A反應轉移電子數為_______mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】摩爾質量是 ______ 的物質所具有的質量![]() 符號: ______
符號: ______ ![]() 單位: ______ 或 ______ .
單位: ______ 或 ______ .
A. 單位物質的量;M;![]() ;
;![]()
B. 物質的量;m;![]() ;
;![]()
C. 單位物質的量;m;g;![]()
D. 物質的量;M;![]() ;kg
;kg
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種利用電解錳陽極泥(主要成分MnO2、MnO)制備MnO2的工藝流程如下:
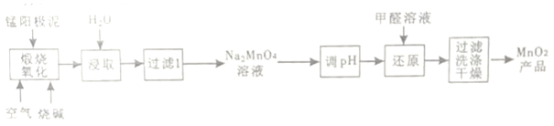
(1)“煅燒氧化”時,1mol MnO煅燒完全轉化為Na2MnO4失去電子的物質的量為___________;MnO2煅燒反應的化學方程式為__________________。
(2)“浸取”時,為提高Na2MnO4的浸取率,可采取的措施有____________、____________(列舉2點)
(3)“調pH”是將溶液pH 調至約為10,防止pH較低時Na2MnO4自身發生氧化還原反應,生成MnO2和___________;寫出用pH試紙測定溶液pH的操作_______________。
(4)“還原”時有無機含氧酸鹽生成,發生反應的化學方程式為_____________。
(5)測定產品中MnO2質量分數的步驟如下:
步驟1. 準確稱取mg產品,加入c1mol·L-1Na2C2O4溶液V1mL (過量)及適量的稀硫酸,水浴加熱煮沸一段時間。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步驟2. 然后用c2mol·L-1KMnO4標準溶液滴定剩余的Na2C2O4滴定至終點時消耗KMnO4標準溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步驟2達滴定終點時判斷依據是_____________;產品中MnO2的質量分數為ω(MnO2)=____________(列出計算的表達式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】德國化學家哈伯因研制合成氨作出重大貢獻而獲得1918年諾貝爾化學獎,如今可以用電化學的方法合成氨,裝置如圖所示,圖中陶瓷在高溫時可以傳輸H+。下列敘述錯誤的是( )
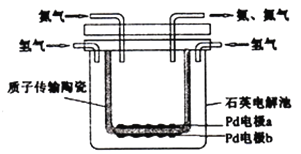
A. Pd電極b為陰極 B. 陰極的反應式為:N2+6H++6e-=2NH3
C. H+由陽極向陰極遷移 D. 陶瓷可以隔離N2和H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(4分)在有機物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、⑤C2H6、⑥CH3CH=CH2中,一定互為同系物的是 ,一定互為同分異構體的是 。(填編號)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com