
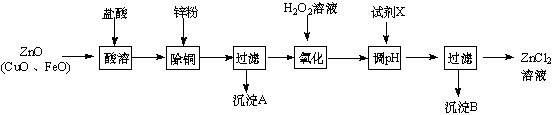
| 金屬離子 | 開始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
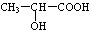 )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的結構簡式為
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的結構簡式為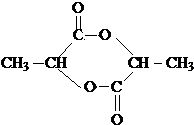 ,聚乳酸的結構簡式為
,聚乳酸的結構簡式為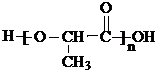 .
.分析 煉鋅煙塵(主要成份為ZnO,含少量CuO和FeO)加鹽酸溶解,形成氯化鋅、氯化銅、氯化亞鐵的溶液,加鋅粉置換出Cu,過濾,濾液中含有鋅離子和亞鐵離子,加過氧化氫氧化,把亞鐵離子氧化為鐵離子,加ZnO(或氫氧化鋅等)調節PH,鐵離子轉化為氫氧化鐵沉淀,過濾除去沉淀,得到氯化鋅溶液,
(1)加過氧化氫把亞鐵離子氧化為鐵離子;
(2)調節pH時要消耗氫離子,但是不能引入雜質;調節pH使鐵離子轉化為沉淀,而鋅離子不沉淀,根據表中數據分析;
(3)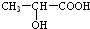 分子中含有-COOH和-OH,兩分子的乳酸分子間發生酯化反應;
分子中含有-COOH和-OH,兩分子的乳酸分子間發生酯化反應;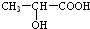 分子間發生縮聚反應生成聚乳酸和水;
分子間發生縮聚反應生成聚乳酸和水;
(4)石墨作電極電解時,陽極氫氧根離子失電子,陰極上[Zn(OH)4]2-得電子;
(5)ZnO能溶液強堿溶液,CuO和FeO不溶于堿溶液.
解答 解:煉鋅煙塵(主要成份為ZnO,含少量CuO和FeO)加鹽酸溶解,形成氯化鋅、氯化銅、氯化亞鐵的溶液,加鋅粉置換出Cu,過濾,濾液中含有鋅離子和亞鐵離子,加過氧化氫氧化,把亞鐵離子氧化為鐵離子,加ZnO(或氫氧化鋅等)調節PH,鐵離子轉化為氫氧化鐵沉淀,過濾除去沉淀,得到氯化鋅溶液,
(1)加過氧化氫亞鐵離子氧化為鐵離子,反應的離子方程式為:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案為:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)調節pH時要消耗氫離子,但是不能引入雜質,ZnO、Zn(OH)2、Zn2(OH)2CO3均與氫離子反應生成鋅離子,消耗氫離子的同時不引人雜質,ZnSO4不能與氫離子反應,所以不能調節pH;調節pH使鐵離子轉化為沉淀,而鋅離子不沉淀,由表中數據可知pH≥3.2時,鐵離子完全沉淀,而鋅離子開始沉淀的pH為5.2,所以要調節pH為3.2≤pH<5.2;
故答案為:abc;3.2≤pH<5.2;
(3)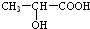 分子中含有-COOH和-OH,兩分子的乳酸分子間發生酯化反應,反應產物為
分子中含有-COOH和-OH,兩分子的乳酸分子間發生酯化反應,反應產物為 ;
;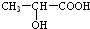 分子間發生縮聚反應生成聚乳酸和水,聚乳酸的結構簡式為:
分子間發生縮聚反應生成聚乳酸和水,聚乳酸的結構簡式為: ;
;
故答案為: ;
; ;
;
(4)石墨作電極電解時,陽極氫氧根離子失電子,陽極反應為:4OH--4e-═2H2O+O2↑,陰極上[Zn(OH)4]2-得電子生成Zn,則陰極的電極方程式為:[Zn(OH)4]2-+2e-=Zn+4OH-;
故答案為:O2;[Zn(OH)4]2-+2e-=Zn+4OH-;
(5)ZnO能溶液強堿溶液,CuO和FeO不溶于堿溶液,酸溶液與ZnO、CuO、FeO均能反應,所以煉鋅煙塵采用堿溶,而不采用酸溶后電解,
故答案為:氧化銅、氧化亞鐵不溶于堿溶液中.
點評 本題考查了物質的制備工藝流程,側重于流程的分析、物質的分離提純、氧化還原反應的應用、酯化反應和縮聚反應、電解原理的應用等知識點的考查,題目難度中等,考查了學生對基礎知識的綜合應用能力.


 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:選擇題
| A. | c (Na+)=c (HB-)+2 c (B2-)+c (H2B) | B. | c(Na+)=0.01 mol/L≥c (B2-) | ||
| C. | c (H+)•c (OH-)=10-14 | D. | c (Na+)+c (H+)=c(HB-)+c (B2-)+c (OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該飽和溶液的物質的量濃度為5.07mol•L-1 | |
| B. | 向該溶液中加入等體積的水之后溶液的質量分數小于13.25% | |
| C. | 25℃時,密度等于1.12g•cm-3的NaCl溶液是飽和溶液 | |
| D. | 將此溶液蒸發掉部分水,再恢復到20℃時,溶液密度一定大于1.12g•cm-3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2,2,3,3-四甲基丁烷 | B. | 3,4-二甲基己烷 | ||
| C. | 2,2,3-三甲基戊烷 | D. | 3-甲基-3-乙基戊烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗探究 | 實驗操作及現象 | 結論分析 |
| 探究一 | 將淡藍綠色粉末溶解于鹽酸溶液中,取上清液2份, ①1份滴加BaCl2溶液,產生白色沉淀,再加鹽酸,無明顯變化. ②另1份溶液先滴加KSCN溶液,無明顯變化,再滴加雙氧水,后滴加KSCN溶液溶液,變成血紅色. | 證明淡藍綠色粉末為FeSO4 |
| 探究二 | 將紅色物質研成粉末,滴加鹽酸,無明顯變化,再滴加KSCN溶液,無明顯現象. | 證明:紅色物質不是Fe2O3. |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com