
 已知:有機氯化劑磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0
已知:有機氯化劑磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0| c(SO2)/mol•L-1 | c(Cl2)/mol•L-1 | v/mol•L-1•S-1 |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 8.0k |
分析 (1)反應放熱反應物的總能量高于生成物總能量,結合蓋斯定律分析;
(2)根據v=k•cm(SO2)•cn (Cl2),利用三組數據列式比較可計算m、n值.
(3)由v=$\frac{△c}{△t}$可知,v正與t的乘積為濃度減小量,v逆與t的乘積為濃度增加量,以此分析SO2的平衡濃度;
(4)①平衡常數等于生成物平衡濃度冪次方乘積除以反應物平衡濃度冪次方乘積,壓強之比等于物質的量之比;
②將nmolSO2與nmolCl2充入容積可變的密閉容器中,得到SO2Cl2,0.4nmol,則恒壓容器中成正比例關系,則0.5nmol二氧化硫和0.5nmolCl2,反應生成SO2Cl20.2nmol;
(5)SO2Cl2遇水發生劇烈水解,且產生白霧,白霧是水解生成HCl與空氣中水蒸氣結合所致,則-SO2-基團結合2個-OH生成H2SO4;氯化銀的溶解度遠遠小于Ag2SO4的溶解度,SO2Cl2溶于水所得溶液中c(H2SO4):c(HCl)=1:2,溶液中離子濃度為硫酸根離子的2倍,故AgCl最先沉淀,根據溶度積可知,溶液中c(Ag+)=$\frac{{K}_{sp}(AgCl)}{C(C{l}^{-})}$,c(SO42-)=$\frac{{K}_{sp}(A{g}_{2}S{O}_{4})}{{C}^{2}(A{g}^{+})}$,據此計算溶液中$\frac{{c}^{2}(C{l}^{-})}{c(S{O}_{4}^{2-})}$.
解答 解:(1)SO2(g)+Cl2(g)?SO2Cl2(g)△H<0①該反應放熱,說明反應物的總能量高于生成物,
SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H1=akJ/mol②,依據蓋斯定律將②-①得SO2Cl2(g)+SCl2(g)?2SOCl2(g)△H2=bkJ/mol③,說明②放出的熱量多,③放出的熱量少,a、b均為副值,所以a<b,
故答案為:<;
(2)v=k•cm(SO2)•cn (Cl2),設三組數據編號分別為①②③,
則有$\frac{②}{①}$=2m=2,m=1;$\frac{③}{②}$=4n=4,n=1,
故答案為:1;1;
(3)恒溫下,若在容積固定的2L密閉容器中,充入SO2、Cl2各2mol,SO2的起始濃度為1mol/L,觀察圖象,縱坐標為SO2的反應速率,橫坐標為時間,由微分法可知,二者之積為濃度,故V(正)×t(平衡)表示B向正反應方向進行時減少的濃度,V(逆)×t(平衡)表示SO2向逆反應方向進行時增大的濃度,故1-S(aob) 的面積表示SO2的平衡濃度,
故答案為:C;
(4)①設反應的二氧化硫物質的量為x,
SO2(g)+Cl2(g)?SO2Cl2(g)
起始量(mol) n n 0
變化量(mol) x x x
平衡量(mol)n-x n-x x
起始氣體總體積為10L,t min時反應達到平衡,此時氣體總體積為8L,$\frac{2n}{2n-2x+x}$=$\frac{10}{8}$,x=$\frac{2}{5}$n,在一定條件下達到平衡狀態時,體系的總壓強為P,其中SO2(g)、Cl2(g)、SO2Cl2(g)物質的量分別為0.6nmol、0.6nmol、0.4nmol,壓強之比等于物質的量之比,Kp=$\frac{\frac{0.4nmol}{0.6nmol+0.6nmol+0.4nmol}P}{(\frac{0.6nmol}{0.6nmol+0.6nmol+0.4nmol}P)^{2}}$=$\frac{16}{9P}$,
故答案為:$\frac{16}{9P}$;
②將nmolSO2與nmolCl2充入容積可變的密閉容器中,得到SO2Cl2,0.4nmol,則恒壓容器中成正比例關系,相同條件下,若將0.5nmolSO2與0.5nmolCl2充入該容器,到達平衡狀態時,消耗二氧化硫物質的量為0.2n,混合物中SO2Cl2的物質的量是0.2nmol,
故答案為:0.2n;
(5)SO2Cl2遇水發生劇烈水解,且產生白霧,白霧是水解生成HCl與空氣中水蒸氣結合所致,則-SO2-基團結合2個-OH生成H2SO4,反應方程式為:SO2Cl2+2H2O=H2SO4+2HCl,Ksp(AgCl)=1.8×10-10,Ksp(Ag2SO4)=1.4×10-5,氯化銀的溶解度遠遠小于Ag2SO4的溶解度,SO2Cl2溶于水所得溶液中c(H2SO4):c(HCl)=1:2,溶液中離子濃度為硫酸根離子的2倍,故AgCl最先沉淀,即最先生成的沉淀是Cl-,當第二種離子SO4 2-開始沉淀時,溶液中c(Cl-)=1×10-5mol/L,c(Ag+)=$\frac{{K}_{sp}(AgCl)}{C(C{l}^{-})}$=$\frac{1.8×1{0}^{-10}}{1×1{0}^{-5}}$=1.8×10-5,c(SO42-)=$\frac{{K}_{sp}(A{g}_{2}S{O}_{4})}{{C}^{2}(A{g}^{+})}$=$\frac{1.4×1{0}^{-5}}{(1.8×1{0}^{-5})^{2}}$,溶液中$\frac{{c}^{2}(C{l}^{-})}{c(S{O}_{4}^{2-})}$=$\frac{(1×1{0}^{-5})^{2}}{\frac{1.4×1{0}^{-5}}{(1.8×1{0}^{-5})^{2}}}$≈2.3×10-15.
故答案為:SO2Cl2+2H2O=H2SO4+2HCl;Cl-;2.3×10-15.
點評 本題考查反應熱大小比較、反應速率、化學平衡、溶度積有關計算等,關鍵是明確原理以及對信息獲取應用,需要學生具備扎實的基礎與靈活運用的能力,題目難度較大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
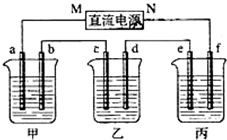 如圖所示裝置中,甲、乙、丙三個燒杯依次分別盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,電極均為石墨電極.
如圖所示裝置中,甲、乙、丙三個燒杯依次分別盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,電極均為石墨電極.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
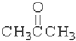 ③
③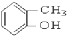 ④
④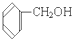 ⑤
⑤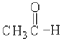 ⑥
⑥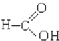
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ① | B. | ③⑤⑥ | C. | ②④⑤ | D. | 全部錯誤 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 生物質資源是一種污染小的可再生能源,可由其制得多種化工原料,如甲醛、甲醇和二甲醚等.
生物質資源是一種污染小的可再生能源,可由其制得多種化工原料,如甲醛、甲醇和二甲醚等.| 容器 | 甲 | 乙 | 丙 |
| 反應物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH平衡時濃度(mol/L) | c1 | c2 | c3 |
| 反應的能量變化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 平衡常數 | K1 | K2 | K3 |
| 反應物轉化率 | a1 | a2 | a3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.2 mol | B. | 0.4 mol | C. | 0.8 mol | D. | 0.9 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
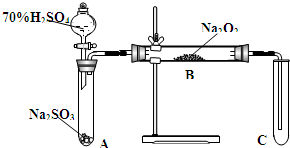 類比思想是化學學習常用的方法.已知Na2O2能與CO2反應,甲同學受到啟發,提出一個相似的觀點:Na2O2與SO2也能夠反應.該同學用如圖所示的裝置進行實驗,充分反應,B中固體由淡黃色變為白色(Na2O2完全反應),將帶火星的木條插入試管C中,木條復燃.
類比思想是化學學習常用的方法.已知Na2O2能與CO2反應,甲同學受到啟發,提出一個相似的觀點:Na2O2與SO2也能夠反應.該同學用如圖所示的裝置進行實驗,充分反應,B中固體由淡黃色變為白色(Na2O2完全反應),將帶火星的木條插入試管C中,木條復燃.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應中C失去電子,被還原 | |
| B. | 該反應中氫氣得到電子,被還原 | |
| C. | 該反應中,每轉移2mole-則生成1mol氫氣. | |
| D. | 該反應屬于復分解反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第五周期第IA族 | D. | 第二周期第IIA族 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com