
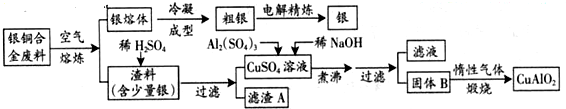
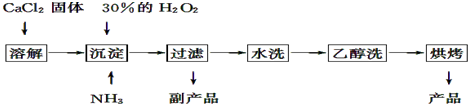
分析 Ⅰ.由工藝流程圖可知,廢料在空氣中熔煉時,Cu被氧化,濾渣中含有CuO及少量Ag,向濾渣中加入硫酸進行酸浸,CuO與硫酸反應,過濾得到硫酸銅溶液(含有硫酸),濾渣A為Ag;向濾液中加入硫酸鋁、氫氧化鈉,得到氫氧化鋁、氫氧化銅,灼燒中會得到CuO、Al2O3,二者反應得到CuAlO2,
(1)未煮沸之前是Cu(OH)2和Al(OH)3,根據Al(OH)3和Cu(OH)2開始分解的溫度分別為450℃和80℃判斷產物;根據氫氧化鋁顯兩性能與堿反應;
(2)根據化合價升降總數相等以及原子守恒來配平;
(3)根據銅元素守恒建立關系式:Cu~CuAlO2,根據鋁元素守恒建立關系式:Al2(SO4)3~2CuAlO2,由上述兩個關系式結合銅的質量可計算Al2(SO4)3溶液的體積;
Ⅱ.三價鐵具有氧化性,硫化氫具有還原性,二者之間發生氧化還原反應,化學方程式為2FeCl3+H2S═2FeCl2+S↓+2HCl,再改寫為離子反應方程式;電解氯化亞鐵時,陽極失去電子發生氧化反應生成Fe3+,結合綠色化學的理論并根據FeCl3可以循環利用確定該實驗的有兩個顯著優點.
解答 解:Ⅰ.由工藝流程圖可知,廢料在空氣中熔煉時,Cu被氧化,濾渣中含有CuO及少量Ag,向濾渣中加入硫酸進行酸浸,CuO與硫酸反應,過濾得到硫酸銅溶液(含有硫酸),濾渣A為Ag;向濾液中加入硫酸鋁、氫氧化鈉,得到氫氧化鋁、氫氧化銅,灼燒中會得到CuO、Al2O3,二者反應得到CuAlO2,
(1)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2開始分解的溫度分別為450℃和80℃,煮沸后Cu(OH)2分解產生氧化銅,可知B為Al(OH)3和CuO,氫氧化鋁顯兩性能與堿反應:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案為:Al(OH)3和CuO;Al(OH)3+OH-=AlO2-+2H2O;
(2)反應前Cu為+2價,反應后為+1,化合價降低1,Al化合價沒有變化,所以氧元素的化合價升高,生成氧氣,反應前氧為-2價,反應后為0,化合價升高2,兩者的最小公倍數是2,再根據原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,
故答案為:4CuO+2Al2O3=4CuAlO2+O2↑;
(4)由關系式:Cu~CuAlO2得n(CuAlO2)=$\frac{5.0×1000×64%}{64}$mol=50.0mol,則CuAlO2為50.0mol,由關系式:Al2(SO4)3~2CuAlO2得Al2(SO4)3=n(CuAlO2)×$\frac{1}{2}$=25.0mol,所以需要體積為$\frac{25.0mol}{1.0mol/L}$=25.0L,
故答案為:25.0;
Ⅱ.(4)FeCl3與H2S發生反應為2FeCl3+H2S=2FeCl2+2HCl+S↓,離子方程式為:2Fe3++H2S=2Fe2++S↓+2H+,
故答案為:2Fe3++H2S=2Fe2++S↓+2H+;
(5)電解氯化亞鐵時,陽極亞鐵離子失去電子發生氧化反應生成Fe3+,電極反應式為Fe2+-e-=Fe3+,故答案為:Fe2+-e-=Fe3+;
(6)根據實驗原理可知,電解池中最終得到的FeCl3可重新用來吸收H2S,得到循環利用,故答案為:FeCl3可以循環利用.
點評 本題以從廢料中回收銀并制備銅化工產品為背景,考查了物質制備原理及其應用,題目難度中等,涉及電解原理、沉淀的判斷、氧化還原反應的書寫以及化學計算等知識,試題知識點較多、綜合性較強,充分考查學生的分析、理解能力及化學實驗、化學計算能力.


 海淀黃岡名師導航系列答案
海淀黃岡名師導航系列答案 普通高中同步練習冊系列答案
普通高中同步練習冊系列答案科目:高中化學 來源: 題型:選擇題
| A. | 它們互為同位素 | B. | 原子核中的中子數相同 | ||
| C. | 具有相同的質子數 | D. | 23595Am比23592U少3個中子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
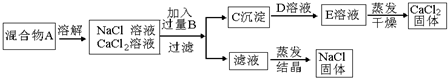
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
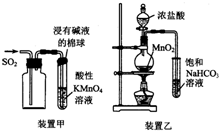
| A. | 用裝置甲收集SO2并驗證其漂白性 | |
| B. | 用裝置乙驗證氯氣與水反應有鹽酸生成 | |
| C. | 用澄清石灰水鑒別蘇打溶液和小蘇打溶液 | |
| D. | 用NaOH溶液除去苯中混有的少量苯酚,反應后分液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
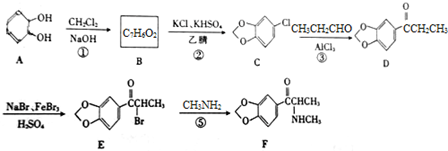
 ;
; (填結構簡式);
(填結構簡式); )的合成路線.
)的合成路線.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質 | 開始沉淀的pH值 | 完全沉淀的pH值 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.4 | 4.4 |
| Cr (OH)3 | 4.6 | 5.9 |
| Fe(OH)2 | 7.5 | 9.7 |
| Bi(OH)3 | 0.7 | 4.5 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
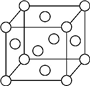 A、B、X、Y、Z是元素周期表前四周期中的常見元素,原子序數依次增大.A元素可形成自然界硬度最大的單質;B與A同周期,核外有三個未成對電子;X原子的第一電離能至第四電離能分別是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常溫常壓下,Y單質是固體,其氧化物是形成酸雨的主要物質;Z的一種同位素的質量數為63,中子數為34.請回答下列問題:
A、B、X、Y、Z是元素周期表前四周期中的常見元素,原子序數依次增大.A元素可形成自然界硬度最大的單質;B與A同周期,核外有三個未成對電子;X原子的第一電離能至第四電離能分別是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常溫常壓下,Y單質是固體,其氧化物是形成酸雨的主要物質;Z的一種同位素的質量數為63,中子數為34.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com