

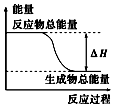
 CO↑+H2O.
CO↑+H2O.
分析 CO的制備方法:HCOOH CO↑+H2O,在題給裝置中,導管a平衡分液漏斗內壓強,使分液漏斗內的液體濃硫酸順利滴下,b主要是起安全瓶的作用,以防止倒吸;c為除去CO中的酸性氣體,選用NaOH溶液,還需用濃硫酸除去CO中的H2O,
CO↑+H2O,在題給裝置中,導管a平衡分液漏斗內壓強,使分液漏斗內的液體濃硫酸順利滴下,b主要是起安全瓶的作用,以防止倒吸;c為除去CO中的酸性氣體,選用NaOH溶液,還需用濃硫酸除去CO中的H2O,
(1)①根據裝置圖中e的構造可知e為分液漏斗;
②為了使產生的氣體能順利的從發生裝置中排出,就必需保持壓強一致,因此a的作用是保持恒壓;
(2)甲酸在濃硫酸作用下脫水生成CO,根據元素守恒和元素守恒可書寫化學方程式;
(3)要檢驗CO中少量S02、C02氣體,用品紅檢驗二氧化硫,并用酸性高錳酸鉀除去二氧化硫,再用品紅檢驗是否除盡,用石灰水檢驗二氧化碳,所以E1中裝置品紅溶液,E2中裝置酸性高錳酸鉀溶液,E3中裝品紅溶液,F中裝澄清石灰水;
(4)題給合成正丁醛的反應為氣體體積減小的放熱反應,為增大反應速率和提高原料氣的轉化率;
(5)根據題中物質提純的流程,粗品中含有正丁醛,利用信息①可知飽和NaHSO3溶液形成沉淀,然后通過過濾即可除去;加入乙醚的目的是萃取溶液中的1-丁醇,1-丁醇和乙醚的沸點相差很大,因此可以利用蒸餾將其分離開
解答 解:CO的制備方法:HCOOH CO↑+H2O,在題給裝置中,導管a平衡分液漏斗內壓強,使分液漏斗內的液體濃硫酸順利滴下,b主要是起安全瓶的作用,以防止倒吸;c為除去CO中的酸性氣體,選用NaOH溶液,還需用濃硫酸除去CO中的H2O,
CO↑+H2O,在題給裝置中,導管a平衡分液漏斗內壓強,使分液漏斗內的液體濃硫酸順利滴下,b主要是起安全瓶的作用,以防止倒吸;c為除去CO中的酸性氣體,選用NaOH溶液,還需用濃硫酸除去CO中的H2O,
(1)①根據儀器e的構造可知e為分液漏斗,故答案為:分液漏斗;
②CO的制備方法為:HCOOH CO↑+H2O,反應中有氣體產生,為了平衡分液漏斗內壓強,使分液漏斗內的液體濃硫酸順利滴下,所以使用了導管a,
CO↑+H2O,反應中有氣體產生,為了平衡分液漏斗內壓強,使分液漏斗內的液體濃硫酸順利滴下,所以使用了導管a,
故答案為:平衡內外壓強,保證液體順暢流下;
(2)甲酸在濃硫酸作用下脫水生成CO氣體和水,反應的化學方程式為:HCOOH CO↑+H2O,
CO↑+H2O,
故答案為:HCOOH CO↑+H2O;
CO↑+H2O;
(3)要檢驗CO中少量S02、C02氣體,用品紅檢驗二氧化硫,并用酸性高錳酸鉀除去二氧化硫,再用品紅檢驗是否除盡,用石灰水檢驗二氧化碳,所以E1中裝置品紅溶液,E2中裝置酸性高錳酸鉀溶液,E3中裝品紅溶液,F中裝澄清石灰水,
①根據上面的分析可知,E1的作用是:檢驗產物是否有S02,E3的作用是檢驗S02是否除盡,
故答案為:檢驗產物是否有S02;檢驗S02是否除盡;
②判斷產物中有CO2的現象是E3中品紅不褪色,F中石灰水變渾濁,
故答案為:E3中品紅不褪色,F中石灰水變渾濁;
(4)由于反應是一個體積減小的可逆反應,所以采用高壓,有利于增大反應速率和提高原料氣的轉化率;正向反應是放熱反應,雖然低溫有利于提高原料氣的轉化率,但不利于增大反應速率,因此要采用適當的溫度;催化劑不能提高原料氣的轉化率,但有利于增大反應速率,縮短到達平衡所需要的時間,故正確所選項是D,
故答案為:D;
(5)粗品中含有正丁醛,根據所給的信息利用飽和NaHSO3溶液形成沉淀,然后通過過濾即可除去;由于飽和NaHSO3溶液是過量的,所以加入乙醚的目的是萃取溶液中的1-丁醇;因為1-丁醇和乙醚的沸點相差很大,因此可以利用蒸餾將其分離開,
故答案為:飽和NaHSO3溶液;萃取;蒸餾.
點評 本題考查制備方案的設計,題目難度中等,涉及氣體的制備、有機物的分離、提純方法、醇的性質以及對基礎知識和基本操作的考查,答題時注意把握基礎知識和基本實驗操作的靈活運用,試題培養了學生的分析、理解能力及化學實驗能力.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋁粉與氧化鐵在加熱條件下的反應 | |
| B. | 灼熱的碳與二氧化碳反應 | |
| C. | Ba(OH)2•8H2O晶體和NH4Cl晶體混合 | |
| D. | 碳與水高溫條件下制取水煤氣的反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在含有大量Al3+的無色溶液中:Cu2+、Na+、Cl-、SO42- | |
| B. | 在含有大量H+的溶液中:Na+、K+、CO32-、NO3- | |
| C. | 在強酸的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 在滴加石蕊顯藍色的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
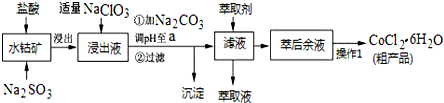
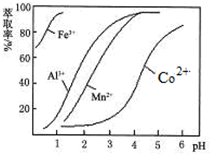
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 開始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
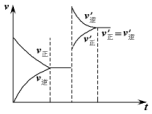 如圖表示在密閉容器中反應C(s)+H2O(g)$\stackrel{高溫}{?}$CO(g)+H2(g);△H>0,達到平衡后,由于條件的改變而引起正、逆反應速率的變化,以及平衡移動的狀況.據圖可知,改變的條件是( )
如圖表示在密閉容器中反應C(s)+H2O(g)$\stackrel{高溫}{?}$CO(g)+H2(g);△H>0,達到平衡后,由于條件的改變而引起正、逆反應速率的變化,以及平衡移動的狀況.據圖可知,改變的條件是( )| A. | 增加CO濃度 | B. | 升高溫度 | C. | 增加水蒸氣 | D. | 增大壓強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 食鹽水、糖水、冰水都屬于混合物 | |
| B. | 燒堿、火堿、消石灰都屬于堿 | |
| C. | KHSO4、HCl、HNO3在水中都能電離出氫離子,都屬于酸 | |
| D. | 溶液、膠體、濁液都屬于穩定的分散系 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com