
分析 (1)根據n=$\frac{m}{M}$計算出二氧化碳的物質的量,再根據n=nNA計算出含有氧原子數目、根據V=nVm計算出標況下二氧化碳的體積;
(2)根據n=$\frac{m}{M}$計算出氯化鎂的物質的量,從而得出鎂離子的物質的量;根據n=nNA計算出含有離子數目;根據氯化鎂的化學式計算出含有鎂離子的物質的量,再根據m=nM計算出質量;
(3)根據n=$\frac{N}{{N}_{A}}$計算出銨根離子的物質的量,根據m=nM計算出銨根離子的質量;銨根離子中含有11個質子、10個電子,根據其物質的量計算出含有雜質的物質的量,n=nNA計算出含有電子數目;
(4)根據m=nM計算出三氧化硫的質量,計算出二氧化硫的物質的量,根據V=nVm計算出標況下二氧化硫的體積;硫燃燒生成二氧化硫,計算出硫原子的物質的量,得出消耗氧氣的物質的量,再計算出標況下氧氣的體積;
(5)相同質量時,物質的量與摩爾質量成反比;分子數與物質的量成正比;相同條件下體積之比等于物質的量之比;
(6)相同條件下,等體積的氣體具有相同的物質的量、分子數;根據甲烷和二氧化碳的分子組成計算出含有原子數之比;根據m=nM計算出二者的質量之比;等體積的甲烷和二氧化碳具有相同的物質的量,根據M=$\frac{m}{n}$計算出平均摩爾質量.
解答 解:(1)8.8克CO2的物質的量為:$\frac{8.8g}{44g/mol}$=0.2mol,0.2mol二氧化碳分子中含有O原子的數目為:0.2NA;標準狀況下0.2mol的體積是:22.4L/mol×0.2mol=4.48L,
故答案為:0.2mol;0.2NA;4.48L;
(2)19克MgCl2的物質的量為:$\frac{19g}{95g/mol}$=0.2mol,0.2mol氯化鎂中含有0.2molMg2+;0.2mol氯化鎂中含有0.2mol鎂離子、0.4mol氯離子,總共含有0.6mol離子,含有離子數目0.6NA;含有Cl-0.4mol的MgCl2中Mg2+的物質的量為:0.4mol×$\frac{1}{2}$=0.2mol,0.2mol鎂離子的質量為:24g/mol×0.2mol=4.8g,
故答案為:0.2mol;0.6NA;4.8g;
(3)3.01×1023個NH4+的物質的量為:$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,質量為:18g/mol×0.5mol=9g;0.5mol銨根離子中含有質子的物質的量為:0.5mol×11=5.5mol,含有電子的數目為:0.5×10×NA=5NA,
故答案為:0.5mol;9g;5NA;
(4)1.5mol SO3的質量為:80g/mol×1.5mol=120g;1.5mol三氧化硫中含有氧原子的物質的量為:1.5mol×3=4.5mol,含有4.5mol氧原子需要二氧化硫的物質的量為:$\frac{4.5mol}{2}$=2.25mol,標準狀況下2.25molSO2的體積為:22.4L/mol×2.25mol=50.4L;16g單質硫的物質的量為:$\frac{16g}{32g/mol}$=0.5mol,0.5molS完全燃燒生成0.5mol二氧化硫需要消耗0.5mol氧氣,標況下0.5mol氧氣的體積為:22.4L/mol×0.5mol=11.2L,
故答案為:120g;50.4;11.2;
(5)相同質量的兩種氣體Cl2、O2,根據根據n=$\frac{m}{M}$可知,它們的物質的量比與摩爾質量成反比,則二者的物質的量之比為:32g/mol:71g/mol=32:71;它們所含分子數=物質的量成正比=32:71;在相同條件下它們的體積比=物質的量之比=32:71,
故答案為:32:71;32:71;32:71;
(6)在同溫同壓下,同體積的甲烷(CH4)和二氧化碳具有相同的物質的量,二者的分子數相等,則分子數之比為1:1;物質的量之比為1:1,原子總數之比為(1×4):(1×3)=4:3;二者的物質的量相等,則質量之比與摩爾質量成正比,則二者的質量之比為:16g/mol:44g/mol=4:11;等體積的甲烷(CH4)和二氧化碳具有相同的物質的量,則混合氣體的平均摩爾質量為:$\frac{16g/mol+44g/mol}{1+1}$=30g/mol,
故答案為:1:1;1:1;4:3;4:11;30g/mol.
點評 本題考查了阿伏伽德羅定律及其推論的綜合應用,題目難度中等,注意掌握阿伏伽德羅定律內容,熟練掌握物質的量與其它物理量之間的轉化關系,試題知識點較多、計算量較大,充分考查學生的分析能力及化學計算能力.


 輕松暑假總復習系列答案
輕松暑假總復習系列答案科目:高中化學 來源: 題型:選擇題
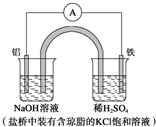
| A. | Fe作正極,發生氧化反應 | |
| B. | 負極反應:Al-3e-+3OH-═Al(OH)3↓ | |
| C. | 工作一段時間后,盛有稀硫酸溶液的杯中pH不變 | |
| D. | 鹽橋中的Cl-向左邊燒杯中移動,使該燒杯中溶液保持電中性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③⑥ | B. | ①③⑥ | C. | ①④⑤ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
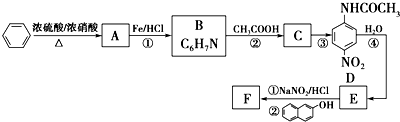
 .
.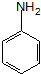 ;設計反應②和④的目的是保護氨基不被氧化.
;設計反應②和④的目的是保護氨基不被氧化.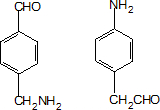 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
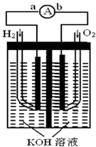 氫氧燃料電池是符合綠色化學理念的新型發電裝置.如圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定,請回答:
氫氧燃料電池是符合綠色化學理念的新型發電裝置.如圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定,請回答:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知A、B、C、D、E五種元素的原子序數依次增大,其中A原子所處的周期數、族序數都與其原子序數相等;B原子核外電子有6種不同的運動狀態;D原子L電子層上有2對成對電子;E+原子核外有3層電子且各層均處于全滿狀態.
已知A、B、C、D、E五種元素的原子序數依次增大,其中A原子所處的周期數、族序數都與其原子序數相等;B原子核外電子有6種不同的運動狀態;D原子L電子層上有2對成對電子;E+原子核外有3層電子且各層均處于全滿狀態. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C60氣化和I2升華克服的作用力相同 | |
| B. | 甲酸甲酯和乙酸的分子式相同,它們的熔點相近 | |
| C. | 氯化鈉和氯化氫溶于水時,破壞的化學鍵都是離子鍵 | |
| D. | 用作高溫結構陶瓷材料的固體是分子晶體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com