
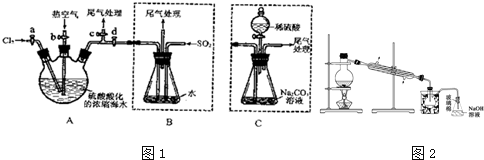
分析 (1)實驗室制備氯氣的反應為二氧化錳和濃鹽酸加熱反應生成氯化錳、氯氣和水;
(2)溴易揮發,步驟②中鼓入熱空氣把A中生成的溴蒸氣排出到B中;
(3)二氧化硫具有還原性,把單質溴還原為溴離子;
(4)溴、氯氣和二氧化硫都有毒,可用堿液吸收;
(5)根據蒸餾所需儀器回答;由于題干中給出信息Br2的沸點是59℃,提純溴必須收集59℃時的餾分,所以控制溫度得到餾分是關鍵;
(6)根據題給信息,溴和碳酸鈉反應生成了溴化鈉和溴酸鈉,化合價升降總數相等和原子守恒配平方程式;
(7)采用C裝置,步驟少,減少了二氧化硫的污染.
解答 解:(1)實驗室制備氯氣的反應為二氧化錳和濃鹽酸加熱反應生成氯化錳、氯氣和水,反應的化學方程式為:MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案為:MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)溴易揮發,升高溫度促進其揮發,所以通入熱空氣的目的是吹出Br2,
故答案為:使A中生成的Br2隨空氣流進入B中;
(3)二氧化硫具有還原性,把單質溴還原為溴離子,反應的方程式為Br2+SO2+2H2O═4H++2Br-+SO42-;
故答案為:Br2+SO2+2H2O═4H++2Br-+SO42-;
(4)氯氣不可能完全反應,氯氣和溴離子反應生成溴單質,未反應的二氧化硫、氯氣和溴都有毒,不能直接排空,且這幾種物質都能和堿反應,所以用堿液吸收;
故答案為:c;
(5)蒸餾需要蒸餾燒瓶、冷凝管、酒精燈、溫度計、牛角管和錐形瓶等;達到提純溴的目的,操作中應控制的關鍵條件是把溫度控制在溴的沸點59°C,并收集該溫度下的餾分,步驟⑤中,用圖2所示裝置進行蒸餾,收集液溴,裝置圖中缺少的必要儀是溫度計和水浴,
故答案為:溫度計;水浴;
(6)根據題給信息,溴和碳酸鈉反應生成了溴化鈉和溴酸鈉,據此寫出反應方程式為:Br2+Na2CO3→NaBr+NaBrO3,根據化合價升降總數相等配平為:3Br2+3Na2CO3→5NaBr+NaBrO3,根據原子守恒,還有產物二氧化碳3mol,故反應方程式為:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,
故答案為:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑;
(7)采用C裝置,步驟少,減少了二氧化硫的污染,
故答案為:操作簡單,污染小.
點評 本題結合海水提取溴的過程,考查了實驗基本操作、實驗方案的評價、氧化還原反應方程式的書寫,在配平時抓住化合價升降總數相等,題目難度中等.


科目:高中化學 來源: 題型:推斷題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
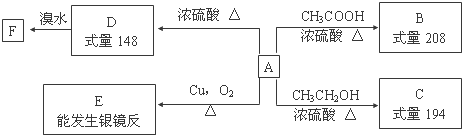
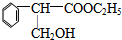 ,F的結構簡式為
,F的結構簡式為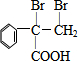 .
.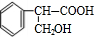 $→_{△}^{濃硫酸}$
$→_{△}^{濃硫酸}$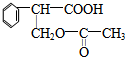 +H2O;②A→E:2
+H2O;②A→E:2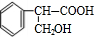 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.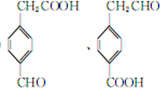 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,22.4L氫氣的物質的量為1mol | |
| B. | 標準狀況下,11.2L水的物質的量為0.5mol | |
| C. | 標準狀況下,32g硫的體積為22.4L | |
| D. | 常溫常壓下,22g二氧化碳的物質的量為0.5mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀釋溶液,水解平衡常數增大 | |
| B. | 加入NaOH固體,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$減小 | |
| C. | 升高溫度,平衡常數減小 | |
| D. | 通入CO2,pH增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 單質A、B、C與化合物甲、乙之間有如圖所示的轉化關系(部分產物已省略).
單質A、B、C與化合物甲、乙之間有如圖所示的轉化關系(部分產物已省略).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 形成離子鍵的陰陽離子間只存在靜電吸引力 | |
| B. | HF、HCl、HBr、HI的熱穩定性依次增強 | |
| C. | 第三周期非金屬元素含氧酸的酸性從左到右依次增強 | |
| D. | 元素周期律是元素原子核外電子排布周期性變化的結果 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com