
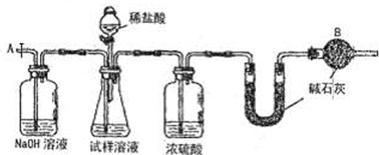
| 106 |
| x |
| 197 |
| wg |
| 106wg |
| 197 |
| 106wg |
| 197mg |
| Ksp(BaCO3) |
| C(Ba 2+) |
| 2.58×10 -9 |
| 0.01 |
| 106wg |
| 197mg |


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:不詳 題型:單選題
| A.1 mol?L-1的MgCl2溶液 |
| B.2 mol?L-1的NaCl溶液 |
| C.1.4 mol?L-1的BaCl2溶液 |
| D.1 mol?L-1的AlCl3溶液 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
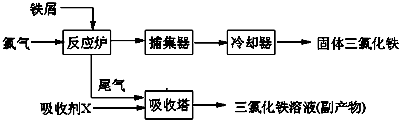
| 溫度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.KSP(AB2)小于KSP(CD),則物質AB2的溶解度一定小于物質CD的溶解度 |
| B.在氯化銀的沉淀溶解平衡體系中,加入蒸餾水,氯化銀的KSP增大 |
| C.在氯化銀的沉淀溶解平衡體系中,加入碘化鉀固體,氯化銀沉淀可轉化為碘化銀沉淀 |
| D.在碳酸鈣的沉淀溶解平衡體系中,加入稀鹽酸,溶解平衡不移動 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
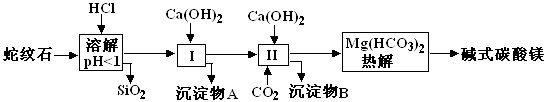
| 氫氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 開始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| 化學式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 顏色 | 白色 | 淺黃色 | 黃色 | 黑色 | 紅色 |
| 溶解度/g | 1.5×10-4 | 7.1×10-7 | 2.1×10-7 | 1.3×10-16 | 4.3×10-2 |
| A.KBr | B.KI | C.K2S | D.K2CrO4 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
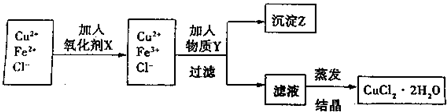
| 氫氧化物開始沉淀時的pH | 氫氧化物沉淀完全時的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| 物質 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
查看答案和解析>>
科目:高中化學 來源:期末題 題型:單選題
查看答案和解析>>
科目:高中化學 來源:同步題 題型:不定項選擇題

 Ba2+(aq)+SO42-(aq)的平衡常數Kap=c(Ba2+)·c(SO42-),稱為溶度積常數。
Ba2+(aq)+SO42-(aq)的平衡常數Kap=c(Ba2+)·c(SO42-),稱為溶度積常數。 查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com