
 .
.分析 (1)氧化劑的氧化性大于氧化產物的氧化性,
①16H++10Z-+2XO4-═2X2++5Z2+8H2O,氧化性:XO4->Z2,
②2A2++B2═2A3++2B-,氧化性:B2>A3+,
③2B-+Z2═B2+2Z-,氧化性:Z2>B2;
(2)該反應中Mn由+7變為+2,MnCl2是還原產物,Cl由-1變為0,Cl2是氧化產物,轉移電子數目為2×(7-2)=10×[0-(-1)]=10;
(3)已知在反應中K2SO3失去電子,則氧化反應為K2SO3→K2SO4,在給出的物質中只有碘元素的化合價降低符合,并利用質量守恒定律來分析反應,利用化合價的變化來分析轉移的電子數.
解答 解:(1)氧化劑的氧化性大于氧化產物的氧化性,
①16H++10Z-+2XO4-═2X2++5Z2+8H2O,氧化性:XO4->Z2,
②2A2++B2═2A3++2B-,氧化性:B2>A3+,
③2B-+Z2═B2+2Z-,氧化性:Z2>B2,
所以氧化性關系為:XO4->Z2>B2>A3+,
故答案為:XO4->Z2>B2>A3+;
(2)該反應中Mn由+7變為+2,MnCl2是還原產物,Cl由-1變為0,Cl2是氧化產物,因此氧化產物和還原產物物質的量之比是5:2,轉移電子數目為2×(7-2)=10×[0-(-1)]=10,用單線橋表示反應中電子轉移的方向和數目為 ,
,
故答案為:5:2; ;
;
(3)①在反應中K2SO3失去電子,則氧化反應為K2SO3→K2SO4,在給出的物質中只有碘元素的化合價降低符合,則還原反應為KIO3→I2,由質量守恒定律可知,該反應在酸性條件下進行,則水為生成物,即反應物為K2SO3、H2SO4、KIO3,生成物為K2SO4、I2、H2O,化學方程式為5K2SO3+2 KIO3+H2SO4═I2+6K2SO4+H2O,
故答案為:5K2SO3;2KIO3;H2SO4;I2;6K2SO4;H2O;
②該反應中碘元素的化合價降低,則氧化劑為KIO3,1mol氧化劑得到電子為1mol×(5-0)=5mol,
故答案為:5.
點評 本題考查氧化還原反應理論,難度中等,明確元素的化合價變化及原子守恒的方法來分析是解答本題的關鍵,并注意反應中化學計量數與轉移電子數目的關系來解答即可.


科目:高中化學 來源: 題型:選擇題
| A. | 增加Zn片質量 | B. | 增加鹽酸的體積 | ||
| C. | 滴加幾滴CuSO4溶液 | D. | 升高溫度 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
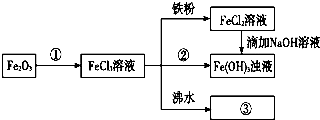
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
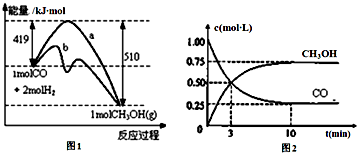 工業上用CO生產燃料甲醇.一定溫度和容積條件下發生反應:CO(g)+2H2(g)?CH3OH(g).圖1表示反應中的能量變化;圖2表示一定溫度下,在體積為1L的密閉容器中加入2mol
工業上用CO生產燃料甲醇.一定溫度和容積條件下發生反應:CO(g)+2H2(g)?CH3OH(g).圖1表示反應中的能量變化;圖2表示一定溫度下,在體積為1L的密閉容器中加入2mol查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用小蘇打治療胃酸過多:CO32-+2H+═CO2↑+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Ca(HCO3)2溶液與少量NaOH溶液反應:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 鐵片放入過量的稀硝酸中:3Fe+8H++2NO3-═3Fe2++2NO2↑+4H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 酸 | 電離常數 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亞硫酸 | K1=1.54×10-2 K2=1.02×10-7 |
| A. | SO2+H2O+2CO32-═2HCO3-+SO32- | B. | SO2+H2O+CO32-═H2CO3+SO32- | ||
| C. | 2SO2+2H2O-+CO32-═H2CO3+2HSO3- | D. | SO2+H2O+CO32-═HCO3-+HSO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 150mL 1mol/L的AlCl3 | B. | 75mL 2mol/L的Al(NO3)3 | ||
| C. | 50mL 3mol/L的AlCl3 | D. | 50mL 3mol/L的AlBr3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com