
【題目】我國每年產生的廢舊鉛蓄電池約330萬噸。從含鉛廢料(PbSO4、PbO2、PbO等)中回收鉛,實現鉛的再生,意義重大。一種回收鉛的工作流程如下:

(1)鉛蓄電池放電時,PbO2作____極。
(2)過程I,已知:PbSO4、PbCO3的溶解度(20℃)見圖l;Na2SO4、Na2CO3的溶解度見圖2。

①根據圖l寫出過程I的離子方程式:__________。
②生產過程中的溫度應保持在40℃,若溫度降低,PbSO4的轉化速率下降。根據圖2,解釋可能原因:
i.溫度降低,反應速率降低; ii.____(請你提出一種合理解釋)。
③若生產過程中溫度低于40℃,所得固體中,含有較多Na2SO4雜質,原因是____。
(3)過程Ⅱ,發生反應2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。實驗中檢測到有大量O2放出,推測PbO2氧化了H2O2,通過實驗證實了這一推測。實驗方案是____。
(已知:PbO2為棕黑色固體;PbO為橙黃色固體)
(4)過程Ⅲ,將PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的電解液,電解Na2PbCl4溶液,生成Pb,如圖3。
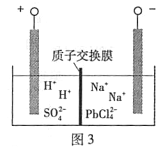
①陰極的電極反應式是____________。
②電解一段時間后,PbCl2'濃度極大下降,為了恢復其濃度且實現物質的循環利用,陰極區采取的方法是_______。
【答案】 正 PbSO4 (s) +CO32- (aq)![]() PbCO3 (s) +SO42- (aq) Na2SO4、Na2CO3濃度降低,反應速率降低 溫度低于40℃時,溫度降低,平衡“Na2SO4(s)
PbCO3 (s) +SO42- (aq) Na2SO4、Na2CO3濃度降低,反應速率降低 溫度低于40℃時,溫度降低,平衡“Na2SO4(s)![]() 2Na+(aq) +SO42- (aq)”逆向移動,產生較多Na2SO4固體雜質 取少量PbO2于試管中,向其中滴加H2O2溶液,產生可使帶火星木條復燃的氣體,同時棕黑色固體變為橙黃色,證實推測正確 PbCl42-+2e-=Pb+4Cl- 繼續向陰極區加PbO粗品
2Na+(aq) +SO42- (aq)”逆向移動,產生較多Na2SO4固體雜質 取少量PbO2于試管中,向其中滴加H2O2溶液,產生可使帶火星木條復燃的氣體,同時棕黑色固體變為橙黃色,證實推測正確 PbCl42-+2e-=Pb+4Cl- 繼續向陰極區加PbO粗品
【解析】(1)鉛蓄電池放電時,PbO2得到電子,作正極。(2)①根據圖l可知碳酸鉛更難溶,則根據沉淀轉化可知過程I的離子方程式為 PbSO4(s)+CO32- (aq)![]() PbCO3(s)+SO42-(aq)。②根據圖2可知溫度降低時Na2SO4、Na2CO3濃度降低,反應速率降低,因此導致轉化率下降。③溫度低于40℃時,溫度降低,平衡“Na2SO4(s)
PbCO3(s)+SO42-(aq)。②根據圖2可知溫度降低時Na2SO4、Na2CO3濃度降低,反應速率降低,因此導致轉化率下降。③溫度低于40℃時,溫度降低,平衡“Na2SO4(s)![]() 2Na+(aq)+SO42-(aq)”逆向移動,產生較多Na2SO4固體雜質。(3)如果PbO2氧化了H2O2,則必然產生PbO,根據顏色可判斷,即取少量PbO2于試管中,向其中滴加H2O2溶液,產生可使帶火星木條復燃的氣體,同時棕黑色固體變為橙黃色,證實推測正確。(4)①陰極發生得到電子的還原反應,則電極反應式是PbCl42-+2e-=Pb+4C1-。②由于PbO能溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的電解液,因此為了恢復其濃度且實現物質的循環利用,陰極區采取的方法是繼續向陰極區加PbO粗品。
2Na+(aq)+SO42-(aq)”逆向移動,產生較多Na2SO4固體雜質。(3)如果PbO2氧化了H2O2,則必然產生PbO,根據顏色可判斷,即取少量PbO2于試管中,向其中滴加H2O2溶液,產生可使帶火星木條復燃的氣體,同時棕黑色固體變為橙黃色,證實推測正確。(4)①陰極發生得到電子的還原反應,則電極反應式是PbCl42-+2e-=Pb+4C1-。②由于PbO能溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的電解液,因此為了恢復其濃度且實現物質的循環利用,陰極區采取的方法是繼續向陰極區加PbO粗品。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】碳氧化物、氮氧化物、二氧化硫的處理與利用是世界各國研究的熱點問題。
消除汽車尾氣中的NO、CO,有利于減少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH2=-565kJ·mol-1
(1)在一定條件下N2和O2會轉化為NO,寫出該反應的熱化學方程式:_________。
(2)為研究不同條件對反應的影響,在恒溫條件下,向2L恒容密閉容器中加入0.2molNO和0.4mol CO,在催化劑存在的條件下發生反應,10min時反應達到平衡,測得10min內v(NO)=7.5×10-3mol·L-1·min-1,則平衡后n(CO)=________mol,關于該平衡的下列說法正確的是________。
a.增大壓強,平衡一定向右移動
b.其他條件不變,升高溫度,化學反應速率一定增大
c.其他條件不變,若改為在恒壓容器中進行,CO的平衡轉化率比恒容條件下大
d.達到平衡后v正(NO)=2v逆(N2)
(3)其他條件相同,t min時不同溫度下測得NO的轉化率如圖所示。

A點的反應速度v正________(填“>”、“<”或“=”)v逆,A、B兩點反應的平衡常數較大的是________(填“A”或“B”)。
(4)已知HNO2的電離常數Ka=7.1×10-4mol·L-1;
NH3·H2O的電離常數Kb=1.7×10-5mol·L-1
則0.1mol·L-1NH4NO2溶液中離子濃度由大到小的順序是____________________________,
常溫下NO2-水解反應的平衡常數Kh=________(保留兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在治療創傷的中藥方劑中,雄性羚羊角或犀牛角的用量極少,但是缺少這味藥,療效將大大下降甚至無效。已知動物的角主要是由死亡細胞的角化(變性)蛋白質組成的,則羚羊角等的有效成分最可能是
A. 特殊活性蛋白質 B. DNA
C. 微量元素類 D. 大量元素類
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向等物質的量濃度的NaOH和Na2CO3的混合溶液中加入稀鹽酸。下列離子方程式與事實不相符的是( )
A. OH-+CO![]() +2H+===HCO
+2H+===HCO![]() +H2O
+H2O
B. 2OH-+CO![]() +3H+===HCO
+3H+===HCO![]() +2H2O
+2H2O
C. 2OH-+CO![]() +4H+===CO2↑+3H2O
+4H+===CO2↑+3H2O
D. OH-+CO![]() +3H+===CO2↑+2H2O
+3H+===CO2↑+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】航天員呼吸產生的CO2用下列反應處理,可實現空間站中O2的循環利用。
sabatior反應:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水電解反應:2H2O(l)![]() 2H2(g) + O2(g)
2H2(g) + O2(g)
(1)將原料氣按nCO2∶nH2=1:4置于密閉容器中發生Sabatier反應,測得H2O(g)的物質的量分數與溫度的關系如圖所示(虛線表示平衡曲線)。
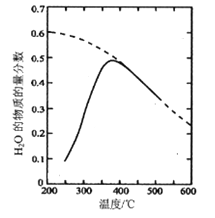
①己知H2(g)、CH4(g)的燃燒熱分別為A kJ/mol、BkJ/mol, H2O(l)=H2O(g) △H =C kJ/mol。計算Sabatier反應的△H=___kJ/mol。
②溫度過高或過低均不利于該反應的進行,原因是________。
③200℃達到平衡時體系的總壓強為p,該反應平衡常數Kp的計算式為________。(不必化簡。用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
(2)Sabatier反應在空間站運行時,下列措施能提高CO2轉化效率的是______(填標號)。
A.適當減壓 B.增大催化劑的比表面積
C.反應器前段加熱,后段冷卻 D.提高原料氣中CO2所占比例
E.合理控制反應器中氣體的流速
(3) 一種新的循環利用方案是用Bosch反應CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反應。
C(s)+2H2O(g)代替Sabatier反應。
在250℃,向體積為2L且帶氣壓計的恒容密閉容器中通入0.08molH2和0.04molCO2發生Bosch 反應CO2(g)+2H2(g)![]() C(s)+2H2O(g) △ H
C(s)+2H2O(g) △ H
①若反應起始和平衡時溫度相同(均為250℃),測得反應過程中壓強(P)隨時間(t)的變化如圖I 曲線a所示,則△H___ 0(填“>”“<”或“不確定”) ;若其它條件相同,僅改變某一條件時,測得其壓強(P)隨時間(t)的變化如圖I 曲線b所示,則改變的條件是______________。
②圖II是甲、乙兩同學描繪上述反應平衡常數的對數值(lgK)與溫度的變化關系,其中正確的曲線是____________(填“甲”或“乙”):m值為____________。

③Bosch反應必須在高溫下才能啟動,原因是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖在盛有溴水的三支試管中分別加入酒精、四氯化碳和苯,振蕩后靜置,出現下列現象,正確的結論是( )

A. ①加了CCl4 ②加了苯 ③加了酒精
B. ①加了苯 ②加了CCl4 ③加了酒精
C. ①加了酒精 ②加了CCl4 ③加了苯
D. ①加了苯 ②加了酒精 ③加了CCl4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向濃度相等、體積均為50 mL的A、B兩份NaOH溶液中,分別通入一定量的CO2后,再稀釋到100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶質的組成可能是①________,②________,③________,④________。

(2)在稀釋后的溶液中逐滴加入0.1 mol ·L-1的鹽酸,產生CO2的體積(標準狀況)與所加鹽酸的體積關系如圖所示。
①A曲線表明,原溶液通入CO2后,所得溶質與鹽酸反應產生CO2的最大體積是________mL(標準狀況)。
②B曲線表明,原溶液通入CO2后,所得溶液中溶質的化學式為______________________。
③原NaOH溶液的物質的量濃度為_____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵晶體俗稱綠礬(FeSO4 7H2O),重鉻酸鈉晶體俗稱紅礬鈉(Na2Cr2O7·2H2O),它們都是重要的化工產品。工業上以鉻鐵礦[主要成分是[Fe(CrO2)2]為原料制備綠礬和紅礬鈉的工藝流程如圖所示。
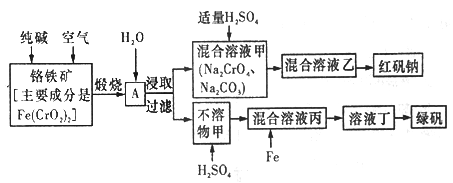
請回答下列問題:
(1)已知Fe(CrO2)2中鉻元素的化合價為+3價,則Fe(CrO2)中鐵元素的化合價為______________。
(2)化學上可將某些鹽寫成氧化物的形式,如Na2SiO3寫成Na2O·SiO2,則Fe(CrO2)2可寫成__________。
(3)煅燒鉻鐵礦時,礦石中的Fe(CrO2)2轉變成可溶于水的Na2CrO4,反應的化學方程式如下:
4Fe(CrO2)2+8Na2CO3+7O2![]() 2Fe2O3+8Na2CrO4+8CO2
2Fe2O3+8Na2CrO4+8CO2
①該反應中還原劑與氧化劑的物質的量之比為________________。
②為了加快該反應的反應速率,可采取的措施是_________________(填一種即可)。
⑷己知CrO42-在氫離子濃度不同的酸性溶液中有不同的反應。如:
2CrO42-+2H+=Cr2O72-+H2O 3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必須適量的原因是________________。
②混合溶液乙中溶質的化學式為______________________。
(5)寫出Fe與混合溶液丙反應的主要離子方程式_________________。檢驗溶液丁中無Fe3+的方法是:_____________。從溶液丁到綠鞏的實驗操作為蒸發濃縮、___________、過濾、洗滌、干燥。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,N2O5在CCl4中發生反應:2N2O5===4NO2+O2,N2O5的濃度隨反應時間(t)的變化如下表。在0~10 s內,平均反應速率為( )
t/s | 0 | 5 | 10 | 15 |
N2O5/(mol·L-1) | 0.82 | 0.40 | 0.32 | 0.28 |
A. v(N2O5)=0.032 mol·L-1
B. v(N2O5)=0.050 mol·L-1
C. v(N2O5)=0.050 mol·L-1·s-1
D. v(N2O5)=0.032 mol·L-1·s-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com