
【題目】蛇紋石礦可以看作由MgO、Fe2O3、Al2O3、SiO2組成。由蛇紋石制取堿式碳酸鎂的實驗步驟如下:
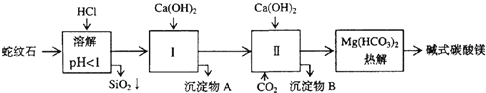
(1)蛇紋石礦加鹽酸溶解后,溶液里除了Mg2+外,還含有的金屬離子是_____。
(2)從沉淀混合物A含有Fe(OH)3和Al(OH)3)中提取紅色氧化物作顏料,先向沉淀物A中加入____溶液 (填入物質的化學式),然后_____、_____、____ (依次填寫實驗操作名稱)。
(3) 物質循環使用,能節約資源。上述實驗中,可以循環使用的物質是____(填寫物質化學式)。
(4)18.2g產品堿式碳酸鎂:aMgCO3·bMg(OH)2·cH2O完全分解后,產生6.6gCO2和8.0g MgO,由此可知,產品的化學式中: a=_____、b=_____、c=___。(列式計算)。
【答案】Fe3+ 、Al3+ NaOH 過濾 洗滌 灼燒 CO2 3 1 3
【解析】
蛇紋石礦的主要成分為MgO、Fe2O3、Al2O3、SiO2,加入鹽酸溶解,SiO2不溶于鹽酸,MgO、Fe2O3、Al2O3與鹽酸反應生成氯化鎂、氯化鐵和氯化鋁;再加入氫氧化鈣生成氫氧化鐵和氫氧化鋁,再加入二氧化碳生成碳酸氫鎂,最后熱解生成堿式碳酸鎂。
(1)綜上分析,加入鹽酸溶解后,溶液中含有金屬離子Mg2+ 、Fe3+ 、Al3+。
(2) 從沉淀混合物A含有Fe(OH)3和Al(OH)3)中提取紅色氧化物作顏料Fe2O3,先要除去氫氧化鋁,故先加入氫氧化鈉生成可溶性Na[Al(OH)4],然后過濾,對沉淀Fe(OH)3進行洗滌、灼燒生成Fe2O3。
(3) 從實驗步驟圖知:步驟Ⅱ中通二氧化碳,作為第Ⅱ步的原料,堿式碳酸氫鎂分解得到CO2,可以循環使用的物質是CO2。
(4) m(樣品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,堿式碳酸鎂分解:aMgCO3bMg(OH)2cH2O![]() (a+b)MgO+aCO2↑+(b+c)H2O↑,根據質量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,則m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得:a:b:c=0.15:0.05:0.15=3:1:3。
(a+b)MgO+aCO2↑+(b+c)H2O↑,根據質量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,則m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得:a:b:c=0.15:0.05:0.15=3:1:3。


科目:高中化學 來源: 題型:
【題目】短周期元素R、T、Q、W在元素周期表中的相對位置如圖所示,其中T所處的周期序數與族序數相等。下列判斷不正確的是( )

A. 最簡單氣態氫化物的熱穩定性:R>Q
B. 最高價氧化物對應水化物的酸性:Q<W
C. 原子半徑:T>Q>R
D. T的最高價氧化物對應的水化物不能和強堿反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素X、Y、Z、W原子序數依次增大,X原子核外有9個電子,Y原子最外層電子數是最內層電子數的一半,Z最高正價是最低負價絕對值的3倍。下列敘述正確的是( )
A. 原子半徑:W<X<Y<Z
B. 化合物Y2Z中既有離子鍵、又有共價鍵
C. Y、W最高價氧化物對應水化物的溶液均能溶解氧化鋁
D. 簡單氣態氫化物的穩定性由強到弱的順序:Z、W、X
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳跟濃硫酸共熱產生的氣體X和銅跟濃硝酸反應產生的氣體Y同時通入盛有足量氯化鋇溶液的洗氣瓶中(如圖裝置),下列有關說法正確的是( )
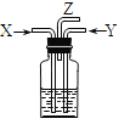
A.洗氣瓶中產生的沉淀是碳酸鋇
B.洗氣瓶中產生的沉淀是硫酸鋇
C.在Z導管出來的氣體中沒有二氧化碳
D.在Z導管口排出無色氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣是一種清潔能源,氫氣的制取與儲存是氫能源利用領域的研究熱點。
已知:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=206.2kJmol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=247.4 kJmol-1
2H2S(g)===2H2(g)+S2(g) ΔH=169.8 kJmol-1
(1)以甲烷為原料制取氫氣是工業上常用的制氫方法。CH4(g)與H2O(g)反應生成CO2(g)和H2(g)的熱化學方程式為__________。
(2)H2S熱分解制氫時,常向反應器中通入一定比例空氣,使部分H2S燃燒,其目的是_____。燃燒生成的SO2與H2S進一步反應,生成物在常溫下均為非氣體,則該反應的化學方程式是______。
(3)將H2S和空氣的混合氣體通入FeCl3、FeCl2、CuCl2的混合溶液中反應回收S,其物質轉化如圖1所示。
①在圖示的轉化中,化合價不變的元素是______。
②反應中當有1 mol H2S轉化為硫單質時,保持溶液中Fe3+的物質的量不變,需消耗O2的物質的量為______。
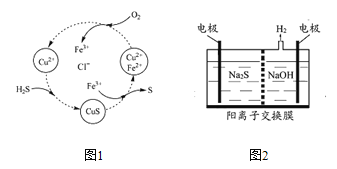
(4)將燒堿吸收H2S后的溶液加入到圖2所示的電解池的陽極區進行電解。電解過程中陽極區發生如下反應:S2--2e-=== S (n-1)S + S2-=== Sn2-
①寫出電解時陰極的電極反應式________。
②電解后陽極區的溶液用稀硫酸酸化得到硫單質,其離子方程式可寫成______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是( )
A.實驗室用大理石和稀鹽酸制取CO2:2H+ + CO32— =CO2↑+ H2O
B.用氫氧化鈉檢驗氯化銨溶液中銨根離子:NH4+ + OH-![]() NH3 ↑+ H2O
NH3 ↑+ H2O
C.在硫酸銅溶液中加入過量氫氧化鋇溶液 Ba2++SO42—=BaSO4↓
D.氯氣與NaOH溶液反應:Cl2 + OH-= Cl- + ClO- + H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某模擬"人工樹葉”電化學實驗裝置如圖所示,該裝置能將H2O和CO2轉化為O2和燃料(C3H8O)。下列說法正確的是
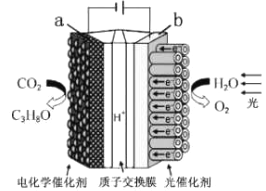
A. 該裝置將化學能轉化為光能和電能
B. 該裝置工作時,H+從b極區向a極區遷移
C. 每生成1 mol O2,有44 gCO2被還原
D. a電極的反應為:3CO2+ 16H+-18e-= C3H8O+4H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各項比較中,一定相等的是
A.等物質的量的OH-和-OH中所含電子數
B.等質量的氧氣和臭氧中含有的氧原子數目
C.1molNa2O2固體中陽離子與陰離子的數目
D.等物質的量的Cu與Fe分別與足量的稀硝酸反應時轉移的電子數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】迷迭香酸是從蜂花屬植物中提取得到的酸性物質,其結構簡式如圖所示。下列敘述正確的是 ( )

A. 迷迭香酸與溴單質只能發生取代反應
B. 1 mol迷迭香酸最多能和9 mol氫氣發生加成反應
C. 迷迭香酸可以發生水解反應、取代反應、消去反應和酯化反應
D. 1 mol迷迭香酸最多能和6 mol NaOH發生反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com