
 元素周期表是指導我們系統學習化學的重要工具.下表是元素周期表的一部分:
元素周期表是指導我們系統學習化學的重要工具.下表是元素周期表的一部分: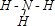 ,故答案為:-3;
,故答案為:-3; ;
; ,
, .
.


科目:高中化學 來源: 題型:
| A、①和② | B、②和③ |
| C、①和③ | D、只有③ |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
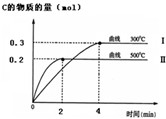 (1)已知在25℃時:①2CO (s)+O2(g)═2CO2(g)△H1=-566KJ/mol
(1)已知在25℃時:①2CO (s)+O2(g)═2CO2(g)△H1=-566KJ/mol查看答案和解析>>
科目:高中化學 來源: 題型:
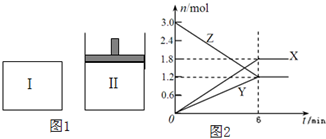 如圖1,在一定溫度下,將等量的氣體分別通入起始體積均為2L的密閉容器Ⅰ(保持溫度、體積不變)和Ⅱ(保持溫度、壓強不變)中,使其發生反應,6min時容器Ⅰ中達到化學平衡,X、Y、Z的物質的量的變化如圖2所示.則下列有關推斷正確的是( )
如圖1,在一定溫度下,將等量的氣體分別通入起始體積均為2L的密閉容器Ⅰ(保持溫度、體積不變)和Ⅱ(保持溫度、壓強不變)中,使其發生反應,6min時容器Ⅰ中達到化學平衡,X、Y、Z的物質的量的變化如圖2所示.則下列有關推斷正確的是( )| A、該反應的化學方程式為:3Z=3X+2Y |
| B、若兩容器中均達到平衡時,則容器Ⅱ達到平衡所需時間大于t0 |
| C、容器Ⅰ中,第5min時Z的消耗速率大于X的消耗速率 |
| D、容器Ⅰ中,前6min內Z的反應速率為0.3mol/(L?min) |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com