
分析 (1)比較金屬性強弱,可以根據金屬與酸反應的劇烈沉淀、構成原電池的負極等方面分析,而與硬度、熔沸點及氫氧化物的穩定性等無關,據此進行解答;
(2)原電池為將化學能轉化為電能的裝置,所涉及反應為自發進行的氧化反應,以此解答該題;
(3)銅不與氫氧化鈉溶液反應,鋁與氫氧化鈉溶液反應生成2Na[Al(OH)4]和氫氣,據此寫出反應的化學方程式;
(4)鋁在濃硝酸中發生鈍化,銅能夠別濃硝酸氧化生成硝酸銅、二氧化氮氣體和水,則銅為原電池的負極.
解答 解:(1)A.鋁和銅的硬度和熔點與金屬性強弱無關,故A錯誤;
B.金屬性越強,與酸反應越劇烈,可通過比較Cu、Al在稀硫酸中的表現判斷其金屬性強弱,故B正確;
C.用鋁片、銅片、硫酸鋁溶液、硫酸銅溶液,根據是否發生置換反應可比較二者的活動性,故C正確;
D.Al與氫氧化鈉溶液反應是鋁的化學性質,與金屬活潑性無關,根據根據是否與氫氧化鈉溶液反應判斷金屬性強弱,故D錯誤;
E.氫氧化鋁為兩性氫氧化物,能夠與氫氧化鈉溶液反應,與金屬性強弱無關,不能根據是否與NaOH溶液反應判斷金屬性強弱,故E錯誤;
F.Al(OH)3和Cu(OH)2的熱穩定性與金屬性強弱無關,無法據此判斷金屬性強弱,故F錯誤;
G.將鋁片、銅片用導線連接后共同浸入濃硝酸中,接入電流計,觀察電流方向,由于鋁與濃硝酸發生鈍化,銅為負極,無法據此判斷金屬性強弱,故G錯誤;
故答案為:BC;
(2)能夠設計成原電池的反應必須為自發進行的氧化還原反應,則滿足體積的有:B.比較二者在稀硫酸中的表現、C.用鋁片、銅片、硫酸鋁溶液、硫酸銅溶液,比較二者的活動性、D.分別做鋁片、銅片與NaOH溶液反應的實驗;而A.比較鋁和銅的硬度和熔點、E.分別做Al(OH)3和Cu(OH)2與NaOH溶液反應的實驗、F.比較Al(OH)3和Cu(OH)2的熱穩定性不滿足,
故答案為:BCD;
(3)D方案中,Cu不與氫氧化鈉溶液反應,Al與NaOH溶液反應的化學方程式為2Al+2NaOH+2H2O=2NaAlO2+3H2↑或2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,
故答案為:2Al+2NaOH+2H2O=2NaAlO2+3H2↑或2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑;
(4)G方案中,因為鋁片在濃硝酸中發生鈍化,該電池的負極是銅片,銅與濃硝酸反應生成硝酸銅、二氧化氮和水,該電池總反應的離子方程式:Cu+4H++2NO3=Cu2++2NO2↑+2H2O,
故答案為:鈍化;銅片; Cu+4H++2NO3=Cu2++2NO2↑+2H2O.
點評 本題考查了性質實驗方案的設計,題目難度中等,設計原電池原理、金屬性強弱比較、氧化還原反應等知識,明確判斷金屬性強弱的方法為解答關鍵,注意掌握原電池的構成條件,試題培養了學生的分析、理解能力及靈活應用能力.


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:選擇題
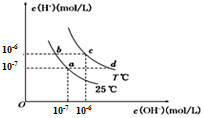 在不同溫度下,水溶液中c(H+)與c(OH- )有如圖所示關系.下列說法正確的是( )
在不同溫度下,水溶液中c(H+)與c(OH- )有如圖所示關系.下列說法正確的是( )| A. | c點對應的溶液pH=6,溶液呈弱酸性 | |
| B. | b點對應的溶液中可以大量共存:NH4+、K+、CO32-、Cl- | |
| C. | 若a點表示CH3COOH和CH3COONa的混合溶液,則該溶液中的離子濃度大小為:c(Na+ )>c(CH3COO-)>C(OH- )>c(H + ) | |
| D. | 若d點表示某等濃度、等體積的NH3•H2O和NH4Cl混合溶液,則溶液中的離子濃度存在如下關系:c(NH4+)+2c(H+)═2c(OH-)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4.6gNO2與N2O4的混合氣體中所含氮原子數為0.1NA | |
| B. | 常溫常壓下1.6g甲烷所含共用電子對數為0.1NA | |
| C. | 標準狀況下,6.72LCO2與足量Na2O2反應轉移電子數為0.6NA | |
| D. | 50ml 98%濃硫酸(密度為1.84g•cm-3)與足量銅共熱,轉移的電子數為0.92NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 生成 SO3 為 2 mol | |
| B. | SO2 和 SO3 物質的量之和一定為 3 mol | |
| C. | 1molO2 恰好反應完 | |
| D. | SO2 的物質的量和 SO3 物質的量一定相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2+H2O═H2SO3 | B. | H2CO3═CO2↑+H2O | ||
| C. | 2NaOH+H2SO4═Na2SO4+2H2O | D. | C+O2$\frac{\underline{\;點燃\;}}{\;}$CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣溶于水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 硫酸氫鈉溶液與氫氧化鋇溶液混合至混合液呈中性:2HSO4-+Ba2++2OH-=BaSO4↓+2H2O+SO42- | |
| C. | 向雙氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | |
| D. | 用銅作陽極電解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+O2↑+4H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無論乙烯與Br2的加成,還是乙烯使酸性KMnO4溶液褪色,都與分子內含有碳碳雙鍵有關 | |
| B. | 用溴的四氯化碳溶液或酸性KMnO4溶液都可以鑒別乙烯和乙烷 | |
| C. | 相同質量的乙烯和甲烷完全燃燒后產生的水的質量相同 | |
| D. | 乙烯的化學性質比乙烷的化學性質活潑 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2S溶液的水解:S2-+2H2O?H2S+2OH- | |
| B. | NaHCO3溶液的電離:HCO3-+H2O?H2 CO3+OH- | |
| C. | 鋼鐵發生吸氧腐蝕時,正極反應式:2H2O+O2+4e-=4OH- | |
| D. | 以石墨作電極,電解硫酸銅溶液,發生氧化反應的電極反應式:Cu-2e-=Cu2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com