
【題目】已知:用Pt—Rh合金催化氧化NH3制NO,其反應的微觀模型及含氮生成物產率隨反應溫度的變化曲線分別如所示:
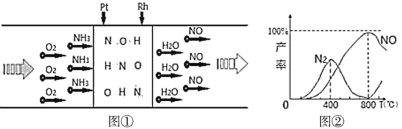
下列說法中,不正確的是( )
A.400℃時,生成的產物只有N2、NO
B.800℃時,反應的化學方程式是:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.Pt—Rh合金可有效提升NH3催化氧化反應的速率
D.800℃以上,發生了反應:2NO![]() O2(g)+N2(g) ΔH>0
O2(g)+N2(g) ΔH>0
【答案】A
【解析】
A.根據圖①②,結合原子守恒知,400℃時,生成的產物有N2、NO和水,故A錯誤;
B.800℃時,生成的含有N元素的產物主要是NO,接近100%,所以發生反應的化學方程式為4NH3+5O2![]() 4NO+6H2O,故B正確;
4NO+6H2O,故B正確;
C.400℃~800℃間,N2的產率下降、NO產率上升,且NO產率接近100%,Pt—Rh合金作催化劑可加快反應速率,所以Pt-Rh合金有效提升NH3催化氧化反應的速率,故C正確;
D.800℃以上,N2的產率上升、NO的產率下降,說明發生了反應2NO![]() O2(g)+N2(g),升高溫度氮氣產率增加,說明該反應的正反應是吸熱反應,△H>0,故D正確;
O2(g)+N2(g),升高溫度氮氣產率增加,說明該反應的正反應是吸熱反應,△H>0,故D正確;
故答案選A。


科目:高中化學 來源: 題型:
【題目】如圖所示,杠桿AB兩端分別掛有體積相同、質量相同的空心銅球和空心鐵球,調節杠桿使其在水中保持平衡,然后小心地向燒杯中央滴入濃CuSO4溶液,一段時間后,下列有關杠桿的偏向判斷正確的是(實驗過程中不考慮鐵絲反應及兩邊浮力的變化) ( )

A. 杠桿為導體和絕緣體時,均為A端高B端低
B. 杠桿為導體和絕緣體時,均為A端低B端高
C. 當杠桿為絕緣體時,A端低B端高;為導體時,A端高B端低
D. 當杠桿為絕緣體時,A端高B端低;為導體時,A端低B端高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反應物中活化分子百分數、化學反應速率和化學平衡常數都變化的是( )
2SO3(g),下列措施能使反應物中活化分子百分數、化學反應速率和化學平衡常數都變化的是( )
A. 增大壓強 B. 升高溫度 C. 使用催化劑 D. 多充O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下的定容密閉容器中,下列情況表明反應A(s)+2B(g)![]() C(g)+D(g) 已達到反應限度的是
C(g)+D(g) 已達到反應限度的是
A. 混合氣體的密度保持不變B. 有1mol C生成的同時有1mol D生成
C. 混合氣體的總物質的量保持不變D. 有1 mol A生成的同時有1mol C消耗
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量的二氧化硫和含0.7 mol氧氣的空氣(忽略CO2)放入一定體積的密閉容器中,550℃時,在催化劑作用下發生反應2SO2+O2![]() 2SO3。反應達到平衡后,將容器中的混合氣體通過過量氫氧化鈉溶液,氣體體積減小了21.28 L;再將剩余氣體通過一種堿性溶液吸收氧氣,氣體的體積又減少了5.6 L(以上氣體體積均為標準狀況下的體積)。(計算結果保留一位小數)請回答下列問題:
2SO3。反應達到平衡后,將容器中的混合氣體通過過量氫氧化鈉溶液,氣體體積減小了21.28 L;再將剩余氣體通過一種堿性溶液吸收氧氣,氣體的體積又減少了5.6 L(以上氣體體積均為標準狀況下的體積)。(計算結果保留一位小數)請回答下列問題:
(1)判斷該反應達到平衡狀態的標志是(填字母)__________________。
a.二氧化硫和三氧化硫濃度相等
b.三氧化硫百分含量保持不變
c.容器中氣體的壓強不變
d.三氧化硫的生成速率與二氧化硫的消耗速率相等
e.容器中混合氣體的密度保持不變
(2)求該反應達到平衡時,消耗二氧化硫的物質的量占原二氧化硫的物質的量的百分比____。
(3)若將平衡混合氣體的5%通入過量的氯化鋇溶液中,生成沉淀的質量是多少?______
查看答案和解析>>
科目:高中化學 來源: 題型:
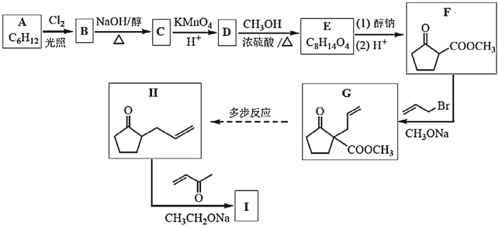
【題目】化合物I是合成六元環甾類化合物的一種中間體。合成I的路線如圖:
已知:①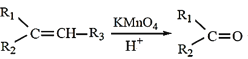 +R3COOH(—R1、—R2、—R3均為烴基)
+R3COOH(—R1、—R2、—R3均為烴基)
②![]()
③
回答下列問題:
(1)苯與H2在一定條件下加成可得A,A的結構簡式是___;
(2)B為一氯代物,B→C的化學方程式是___;
(3)D中的官能團名稱是___;
(4)D→E的化學方程式是___;
(5)下列說法正確的是__;
a.物質F的核磁共振氫譜有2組吸收峰;
b.F→G的反應類型為加成
c.1mol物質G與氫氣加成最多消耗氫氣的物質的量為2mol;
d.物質H存在順反異構體;
(6)物質I的結構簡式是___;
(7)請寫出以B為原料(其他試劑任選)合成![]() 的路線______。
的路線______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知2SO2(g)+O2(g)![]() 2SO3(g)為放熱反應,其實驗數據如下:
2SO3(g)為放熱反應,其實驗數據如下:
壓強/Mpa 轉化率 溫度/℃ | 0.1 | 0.5 | 1 | 5 | 10 |
450 | 97.5% | 98.9% | 99.2% | 99.6% | 99.7% |
550 | 85.6% | 92.9% | 94.2% | 97.7% | 98.3% |
(1)應選用的溫度是________,其理由是______________________________。
(2)應選用的壓強是________,其理由是_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,在體積為10L的密閉容器中充入1mol X和1mol Y進行反應:2X(g)+Y(g)![]() Z(g),60s后反應達到平衡,生成Z的物質的量為0.3mol。下列說法正確的是
Z(g),60s后反應達到平衡,生成Z的物質的量為0.3mol。下列說法正確的是
A.X的平衡轉化率為40%
B.若將容器體積變為20L,則Z的平衡濃度小于原來的![]()
C.若增大壓強,則Y的平衡轉化率減小
D.若升高溫度,X的體積分數增大,則該反應的ΔH>0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,離子方程式為:Fe3++3SCN-
Fe(SCN)3+3KCl,離子方程式為:Fe3++3SCN-![]() Fe(SCN)3,達到平衡后,進行下列操作,平衡怎樣移動?
Fe(SCN)3,達到平衡后,進行下列操作,平衡怎樣移動?
(1)加入少量FeCl3固體:平衡向____________移動;
(2)加入少量KSCN固體:平衡向____________移動;
(3)加入少量KCl固體:平衡____________移動,其理由是____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com