解答:
解:(1)前3 min,v(C)=
=
=0.4 mol?L
-1?min
-1,故答案為:0.4 mol?L
-1?min
-1;
(2)根據圖中數據知道,A、B、C、D四種物質的物質的量的變化量之比是0.4:0.2:0.6:0.2=2:1:3:1,等于方程式的系數之比,方程式表示為:2A(g)+B(g)?3C(g)+D(s),
A.反應前后氣體的體積不變,所以混合氣體的壓強不變化,不一定平衡,故A錯誤;
B.混合氣體的密度等于質量和體積的比值,質量變化,體積不變,所以當密度不變了,達到了平衡,故B正確;
C.混合氣體的平均相對分子質量是質量和物質的量的比值,質量變化,物質的量不變,所以當混合氣體的平均相對分子質量不變了,達到了平衡,故C正確;
D.B的物質的量不變化,是平衡狀態的特征,達到了平衡,故D正確;
E.混合氣體的總的物質的量始終是不變化的,故E錯誤.
故答案為:BCD.
(3)當達到平衡時,平衡常數K=
=
=1.69,故答案為:1.69;
(4)反應2A(g)+B(g)?3C(g)+D(s),達到平衡后,
A.保持體積不變,通入2mol A和1mol B,會使得A的轉化率減小,故A錯誤;
B.D是固體,移走一部分D,平衡不移動,A的轉化率不變,故B正確;
C.把容器的體積縮小一倍,即加壓,平衡不移動,A的轉化率不變,故C正確;
D.升高溫度,平衡逆向移動,A的轉化率減小,故D錯誤.
故答案為:BC.
(5)T℃時,容積為1 L的密閉容器中,起始充入0.2mol A、0.4 mol B、0.3 mol C、0.5mol D,此時Qc=
=
=1.69=K,仍然是平衡狀態,故正逆反應速率相等,故答案為:=;濃度商與平衡常數相等或Q
c=K.

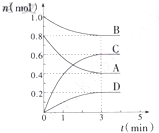 在T℃時,在容積為0.5L的密閉容器中發生如下反應:mA(g)+nB(g)?pC(g)+qD(s),△H<0(m、n、p、q為最簡整數比).A、B、C、D物質的量的變化如圖所示:
在T℃時,在容積為0.5L的密閉容器中發生如下反應:mA(g)+nB(g)?pC(g)+qD(s),△H<0(m、n、p、q為最簡整數比).A、B、C、D物質的量的變化如圖所示:

 習題精選系列答案
習題精選系列答案