
| A. | 在放電時,正極發生的反應是Pb(s)+SO42-(aq)-2e-═PbSO4(s) | |
| B. | 在放電時,該電池的負極材料是鉛板 | |
| C. | 在充電時,電池中硫酸的濃度不斷變小 | |
| D. | 在充電時,陽極發生的反應是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
分析 放電時,該裝置是原電池,負極上鉛失電子發生氧化反應,正極上二氧化鉛得電子發生還原反應,根據電池總反應可知反應消耗硫酸,所以硫酸的濃度減小,結合電極反應式分析判斷.
解答 解:A.放電時,該裝置是原電池,正極上二氧化鉛得電子發生還原反應,則正極發生的反應是PbO2+4H++SO42-+2e-=PbSO4(s)+2H2O,故A錯誤;
B.放電時,該裝置是原電池,負極上鉛失電子發生氧化反應,故B正確;
C.放電時,電池反應要消耗硫酸,所以硫酸的濃度減小,故C錯誤;
D.充電時陽極發生氧化反應,陽極反應為PbSO4-2e-+2H2O=PbO2+SO42-+4H+,故D錯誤;
故選B.
點評 本題考查了原電池和電解池原理,難點是電極反應式的書寫,根據得失電子結合電解質溶液寫電極反應式,題目難度不大.


科目:高中化學 來源: 題型:解答題
 在水的電離平衡中,c(H+)和c(OH-)的關系如圖所示:
在水的電離平衡中,c(H+)和c(OH-)的關系如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 鋅做負極發生氧化反應 | |
| B. | 供電時的總反應為:Zn+2H+═Zn2++H2↑ | |
| C. | 該裝置可實現化學能轉化為電能 | |
| D. | 產生1 g H2,消耗鋅的質量65 g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3.0 mol | B. | 1.5mol | C. | 1.0mol | D. | 0.75mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 植物油存放過久,會有一種難聞的“哈喇”味,但不影響食用 | |
| B. | 葡萄糖能發生水解反應 | |
| C. | 淀粉和纖維素水解的最終產物是葡萄糖 | |
| D. | 氨基酸分子中含有氨基和羧基,因此具有兩性,但蛋白質沒有兩性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 甲乙丙丁戊是中學常見的無機物,他們的轉化關系如圖所示(某些條件和部分產物已略去).下列說法錯誤的是( )
甲乙丙丁戊是中學常見的無機物,他們的轉化關系如圖所示(某些條件和部分產物已略去).下列說法錯誤的是( )| A. | 若戊為一種強堿且焰色反應為黃色,則上述反應可能都屬于氧化還原反應 | |
| B. | 常溫下,若丙為無色氣體,戊為紅棕色氣體,則甲、乙一定是銅和稀硝酸 | |
| C. | 若甲為硫磺燃燒產物,丁為水,則戊可用于干燥甲 | |
| D. | 若甲為濃鹽酸,乙為MnO2,則戊可能使品紅褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 化工工業中常用乙苯脫氫的方法制備苯乙烯.
化工工業中常用乙苯脫氫的方法制備苯乙烯.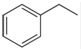 (g)→
(g)→ (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; (g)+CO(g)+H2O(g) △H=+158.8 kJ/mol
(g)+CO(g)+H2O(g) △H=+158.8 kJ/mol查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com