
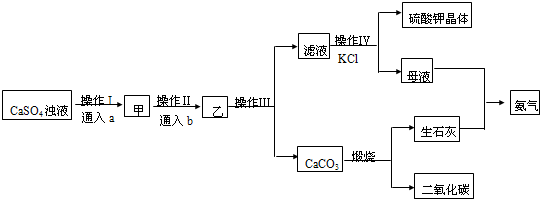
分析 向硫酸鈣濁液中通入氨氣后,溶液顯示堿性,然后再通入適量CO2,反應化學反應:CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓,過濾后得到硫酸氨濾液和碳酸鈣沉淀,硫酸氨溶液中加入氯化鉀,根據溶解度差異,可以得到溶解度較小的硫酸鉀晶體和氯化銨溶液,碳酸鈣高溫下分解得到的氧化鈣溶于水,可以得到氫氧化鈣,氫氧化鈣和氯化銨之間反應,得到氨氣,可以循環使用.
(1)向硫酸鈣濁液中通入氨氣后,溶液顯示堿性,然后再通入適量CO2,會發生復分解反應;
(2)CO2微溶于水,NH3易溶于水,先通入足量NH3,使溶液呈堿性,然后再通入適量CO2,可以保證二氧化碳被充分吸收;
(3)固體和溶液的分離,應為過濾,根據過濾用到的儀器來回答;
(4)根據物質的溶解度大小不同,確定析出的物質以及發生的反應類型,反應應需在密閉容器中進行,防止濃氨水的揮發,根據銨根離子具有的性質檢驗;
(5)流程中所投入的原料和尾氣成分相同的物質可循環使用.
解答 解:向硫酸鈣濁液中通入氨氣后,溶液顯示堿性,然后再通入適量CO2,反應化學反應:CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓,過濾后得到硫酸氨濾液和碳酸鈣沉淀,硫酸氨溶液中加入氯化鉀,根據溶解度差異,可以得到溶解度較小的硫酸鉀晶體和氯化銨溶液,碳酸鈣高溫下分解得到的氧化鈣溶于水,可以得到氫氧化鈣,氫氧化鈣和氯化銨之間反應,得到氨氣,可以循環使用.
(1)向硫酸鈣濁液中通入氨氣后,溶液顯示堿性,然后再通入適量CO2,反應化學反應:CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓,故答案為:CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓;
(2)由于CO2微溶于水,NH3易溶于水,應先通入足量NH3,使溶液呈堿性,然后再通入適量CO2,故選B;
(3)操作III為CaCO3和溶液的分離,應為過濾,過濾時所需要的儀器有燒杯、普通漏斗以及玻璃棒,玻璃棒的作用是引流,防止液體外濺,故答案為:ac;引流;
(4)操作IV濾液硫酸銨溶液與KCl需在濃氨水中發生反應,析出K2SO4晶體,原理是物質的溶解度大小不同,物質間發生復分解,析出溶解度小的物質,濃氨水的作用是降低硫酸鉀的溶解度,利于硫酸鉀的析出,應需在密閉容器中進行,防止濃氨水的揮發,該操作得到的母液中所含的主要陽離子是銨根離子,檢驗方法是取溶液少許,向其中加入NaOH溶液并加熱,生成有刺激性氣味的氣體并能使濕潤的紅色石蕊試紙變藍,
故答案為:復分解反應;降低硫酸鉀的溶解度,利于硫酸鉀的析出;濃氨水易揮發;取溶液少許,向其中加入NaOH溶液并加熱,生成有刺激性氣味的氣體并能使濕潤的紅色石蕊試紙變藍;
(5)a為NH3,b為CO2,所投入的原料和尾氣成分相同,則CO2、NH3可循環使用故答案為:CO2、NH3,故答案為:CO2、NH3.
點評 本題考查制備實驗方案的設計,題目難度中等,注意學習中要善于積累基本化學實驗操作知識,把握實驗原理是解答該題的關鍵.


科目:高中化學 來源: 題型:多選題
| A. | 生成CO2的物質的量為2 mol | B. | 生成CO2的體積為4.48L | ||
| C. | 生成O2的體積為4.48L | D. | 生成CO2的分子數為1.204×1023個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溫度下KOH的溶解度為$\frac{2a}{1-2a%}$g | |
| B. | 原溶液的質量為3mg | |
| C. | 可以求算原溶液的物質的量濃度 | |
| D. | 保持溫度不變,向原溶液中加入2a g KOH可達飽和 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol 過氧化鈉中陰離子所帶的負電荷數為NA | |
| B. | mg${\;}_{Z}^{A}$Xn-中所含電子總數為(Z+n)m$\frac{N_A}{A}$ | |
| C. | 100mL 0.1mol•L-1的稀醋酸中含有H+個數為0.01NA | |
| D. | 11.2L CO2所含的原子個數為1.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應中氨氣是還原劑 | B. | 該反應利用了Cl2的強氧化性 | ||
| C. | 該反應HCl是氧化產物 | D. | 生成1molN2有6mol電子轉移 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com