
| A. | 氨水能跟氯化亞鐵溶液反應生成氫氧化亞鐵 | |
| B. | 銨鹽受熱易分解 | |
| C. | 0.1mol/L的氨水可以使酚酞試液變紅 | |
| D. | 0.1mol/L的NH4Cl溶液的pH約為5 |
分析 一水合氨是弱堿,說明一水合氨部分電離,溶液中存在電離平衡,根據一水合氨的電離程度劃分強弱電解質,據此分析解答.
解答 解:A、氨水能跟氯化亞鐵溶液反應生成氫氧化亞鐵,說明氨水顯堿性,不一定是弱堿,故A錯誤;
B、銨鹽受熱分解說明銨鹽不穩定,與一水合氨電離程度無關,故B錯誤;
C、0.1mol/L的氨水可以使酚酞試液變紅說明一水合氨能電離出氫氧根離子,而不能說明一水合氨的電離程度,所以不能證明一水合氨是弱電解質,故C錯誤;
D、0.1mol/L的氯化銨溶液的pH約為5,說明氯化銨為強酸弱堿鹽,銨根離子水解而導致溶液呈酸性,則一水合氨為弱電解質,故D正確;
故選D.
點評 本題考查了電解質強弱的判斷,根據電離程度劃分強弱電解質,不能根據電解質溶液的導電性及電解質的溶解性強弱確定強弱電解質,為易錯點.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:多選題
| A. | 此法的優點之一是原料來源豐富 | |
| B. | 進行第①②③步驟的目的是從海水中提取氯化鎂 | |
| C. | 第④步處理的方法是:用CO將③得到的產物還原,得到鎂 | |
| D. | 以上提取鎂的過程中涉及到的反應有分解反應、化合反應和置換反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH固體 | B. | NaCl固體 | C. | H2O | D. | CaCO3固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金剛石晶體中的最小碳原子環由6個碳原子構成 | |
| B. | 金剛石晶體中的碳原子是sp2雜化的 | |
| C. | 12g金剛石中含有C-C鍵的個數為4NA | |
| D. | 金剛石化學性質穩定,即使在高溫下也不會和O2反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
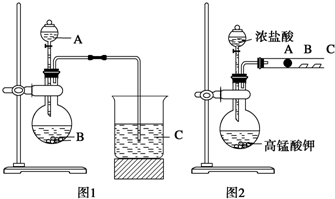
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 乙烯氣相直接水合反應,在其他條件相同時,分別測得C2H4的平衡轉化率在不同壓強(P1、P2)下隨溫度變化的曲線如圖.結合曲線歸納平衡轉化率
乙烯氣相直接水合反應,在其他條件相同時,分別測得C2H4的平衡轉化率在不同壓強(P1、P2)下隨溫度變化的曲線如圖.結合曲線歸納平衡轉化率查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
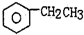 (g)$\stackrel{560℃}{?}$
(g)$\stackrel{560℃}{?}$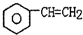 (g)+H2(g)△H<0
(g)+H2(g)△H<0| A. | 加入適當催化劑,可以提高乙苯的轉化率 | |
| B. | 在保持體積一定的條件下,充入較多的乙苯,可以提高乙本的轉化率 | |
| C. | 在加入乙苯至達到平衡過程中,混合氣體的平均相對分子質量不變 | |
| D. | 僅從平衡移動的角度分析,工業生產苯乙稀選擇恒壓條件優于恒容條件 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com