
【題目】常溫下向20.00 mL 0.10 mol/L Na2CO3溶液中逐滴加入0.10 mol/L鹽酸40.00 mL,所得溶液的pH與加入鹽酸體積的關系如表所示:
溶液的pH | 加入鹽酸的總體積 |
12 | V(HCl)=0 |
8 | V(HCl)=20.00 mL |
5 | V(HCl)=40.00 mL |
回答下列問題:
(1)20.00 mL 0.10 mol/L Na2CO3溶液中所有陽離子和陰離子的濃度有何關系?______ (用等式表示)。
(2)當V(HCl)=20.00 mL時,溶液呈堿性的原因是________(用離子方程式和必要的文字說明)此時溶液中c(H2CO3)____(填“>”、“<”或“=”)c(CO32—)。
(3)V(HCl)=40.00 mL時,得到H2CO3飽和溶液,且c(H2CO3)=4.0×10-5mol/L。若忽略水的電離及H2CO3的第二級電離,則H2CO3![]() HCO3—+H+的電離常數K1=_____。此時保持其他條件不變,繼續加入0.1 mol/L鹽酸10.00 mL,K1將_____(填“變大”、“變小”或“不變”)。
HCO3—+H+的電離常數K1=_____。此時保持其他條件不變,繼續加入0.1 mol/L鹽酸10.00 mL,K1將_____(填“變大”、“變小”或“不變”)。
(4)若向20 mL 0.10 mol/L Na2CO3溶液中加入BaCl2粉末3.94×10-7 g時開始產生沉淀BaCO3,則Ksp(Ba2CO3)= 。
【答案】c(Na+)+c(H+)=2c(CO32—)+c(HCO3—)+c(OH-)Na2CO3+HCl=NaCl+NaHCO3,HCO3—+H2O![]() H2CO3+OH-,HCO3—
H2CO3+OH-,HCO3—![]() H++CO32—,HCCO3—的水解程度大于電離程度2.5×10-6不變9.5×10-9
H++CO32—,HCCO3—的水解程度大于電離程度2.5×10-6不變9.5×10-9
【解析】
(1)根據電荷守恒解答;(2)當V(HCl)=20.00 mL恰好反應生成NaHCO3和NaCl等濃度的混合溶液, 因為溶液中的HCO3-水解程度大于其電離程度,所以溶液呈堿性;(3) V(HCl)=40.00 mL時,得到H2CO3飽和溶液,且c(H2CO3)=4.0×10-5mol/L,此時溶液PH=5,則溶液中c(H+)=10-5mol/L,若忽略水的電離及H2CO3的第二級電離,則溶液中c(HCO3-)和c(H+)近似相等,再根據電離常數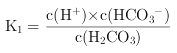 計算;電離平衡常數只受溫度影響,溫度不變,電離平衡常數不變;(4)計算開始沉淀時C(Ba2+),再根據
計算;電離平衡常數只受溫度影響,溫度不變,電離平衡常數不變;(4)計算開始沉淀時C(Ba2+),再根據![]() 計算。
計算。
(1)在Na2CO3溶液中,存在平衡:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-,HCO
+OH-,HCO![]() +H2O
+H2O![]() H2CO3+OH-,H2O
H2CO3+OH-,H2O![]() H++OH-,根據電荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HCO
H++OH-,根據電荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HCO![]() )+2c(CO
)+2c(CO![]() )。答案:c(Na+)+c(H+)=2c(CO
)。答案:c(Na+)+c(H+)=2c(CO![]() )+c(HCO
)+c(HCO![]() )+c(OH-)。
)+c(OH-)。
(2)當加入鹽酸20.00 mL時,發生反應:Na2CO3+HCl===NaCl+NaHCO3,HCO![]() +H2O
+H2O![]() H2CO3+OH-,HCO
H2CO3+OH-,HCO![]()
![]() H++CO
H++CO![]() ,因HCO
,因HCO![]() 的水解程度大于電離程度,c(H2CO3)>c(CO
的水解程度大于電離程度,c(H2CO3)>c(CO![]() ),使溶液呈堿性。
),使溶液呈堿性。
(3)H2CO3![]() H++HCO
H++HCO![]() ,K1=
,K1=![]() =
=![]() =
=![]() =2.5×10-6,電離常數只與溫度有關,溫度不變,K1不變。
=2.5×10-6,電離常數只與溫度有關,溫度不變,K1不變。
(4)Ksp(BaCO3)=c(CO![]() )·c(Ba2+)=0.10×
)·c(Ba2+)=0.10×![]() ≈9.5×10-9。
≈9.5×10-9。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列反應最終不能生成三價鐵的是( )
A.少量Fe與足量稀HNO3反應B.鐵絲在硫蒸氣中燃燒
C.Fe(OH)2露置于空氣中D.向FeBr2溶液中通入足量Cl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下圖所示的實驗裝置A加熱Cu(NO3)2固體,產生紅棕色氣體,在裝置D中收集到無色氣體。當反應結束后,試管中殘留固體為黑色

(1)裝置A發生反應中氧化產物與還原產物的體積比是___________(相同條件下)。
(2)裝置B的作用是___________,反應一段時間后,將帶火星的木條放入B中,木條復燃,說明該紅棕色氣體可助燃,原因是______________________。
(3)已知NO2和NaOH溶液反應可生成兩種鈉鹽,裝置C中發生的離子方程式為_________。
(4)將反應后試管中的固體加水充分溶解、過濾、洗滌,向濾渣中加入一定量稀硫酸,發現固體全部溶解,得到藍色溶液,分為兩份。
①一份溶液經___________、___________、___________、洗滌得藍色晶體。
②另一份取20mL溶液,加入過量KI,充分反應后,用0.5000mol·L-1的Na2S2O3溶液來滴定反應產物,終點時消耗Na2S2O3溶液40.00mL,則上述溶液中c(Cu2+)=___________ mol·L-1。(已知2Cu2++4I-=2CuI↓+I2;I2+2S2O32-=21-+S4O62-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Q、X、Y和Z為短周期元素,它們在周期表中的位置如圖所示,這4種元素的原子最外層電子數之和為22。下列說法正確的是( )

A.Q的單質具有半導體的性質,Q與Z可形成化合物QZ4
B.Q的最高價氧化物的水化物的酸性比Z的強
C.X氫化物的穩定性比Q強
D.Y的原子半徑比X的大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氧化鈉固體在實驗室保存中容易變質。現取一定量的久存氫氧化鈉固體樣品溶于水,向所得溶液中逐滴加入稀鹽酸至過量,生成的CO2(標準狀況)與加入的鹽酸體積有如圖關系

(不考慮CO2在水中的溶解)。試計算:
(1)鹽酸的物質的量濃度為________mol/L。
(2)該樣品中NaOH與Na2CO3物質的量之比為________。
(3)若該氫氧化鈉固體樣品溶于水后用于吸收CO2,最多能吸收CO2的體積(標況下)是________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】給定條件下,下列選項中所示的物質間轉化均能一步實現的組合是
① FeS2![]() SO2
SO2![]() H2SO4
H2SO4
② SiO2![]() SiCl4
SiCl4![]() Si
Si
③ Al![]() NaAlO2(aq)
NaAlO2(aq)![]() NaAlO2(s)
NaAlO2(s)
④ 1 mol·L1HCl(aq)![]() Cl2
Cl2![]() Ca(ClO)2
Ca(ClO)2
⑤ CuSO4(aq)![]() Cu(OH)2
Cu(OH)2![]() CuO
CuO
⑥ 飽和NaCl溶液![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
A. ①③⑤ B. ①③⑥
C. ②③④ D. ①④⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在反應中,X元素的原子將電子轉移給Y元素的原子,則下列說法正確的是
①元素X被氧化 ②元素Y被氧化 ③元素X發生還原反應 ④元素Y發生還原反應
A. ①② B. ③④ C. ②③ D. ①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋼鐵工業是國家工業的基礎,鋼鐵生銹現象卻隨處可見,為此每年國家損失大量資金。請回答鋼鐵腐蝕與防護過程中的有關問題。
(1)鋼鐵的電化學腐蝕原理如圖所示:
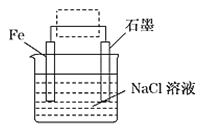
①寫出石墨電極的電極反應式____________。
②該裝置作簡單修改即可成為鋼鐵電化學防護的裝置,請在圖虛線框內所示位置作出修改,并用箭頭標出導線中電子流動方向____________。
③寫出修改后石墨電極的電極反應式________________。
(2)生產中可用鹽酸來除鐵銹。現將一生銹的鐵片放入鹽酸中,當鐵銹被除盡后,溶液中發生的化合反應的化學方程式_______________________。
(3)在實際生產中,可在鐵件的表面鍍銅防止鐵被腐蝕。裝置示意如圖:

①A電極對應的金屬是________(寫元素名稱),B電極的電極反應式是_______。
②若電鍍前鐵、銅兩片金屬質量相同,電鍍完成后將它們取出洗凈、烘干、稱量,二者質量差為5.12g,則電鍍時電路中通過的電子為______mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C、N、S的氧化物常會造成一些環境問題,科研工作者正在研究用各種化學方法來消除這些物質對環境的影響。
(1)已知:2C(s)+O2(g)=2CO(g) ΔH1=-221 kJ·molˉ1
4Al(g)+3O2(g) =2Al2O3(s) ΔH2=-3351 kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318 kJ·molˉ1
碳熱還原Al2O3合成 AlN 的總熱化學方程式是___________________;
(2) “亞硫酸鹽法”吸收煙氣中的SO2,室溫條件下,將煙氣通入(NH4)2SO3溶液中,測得溶液pH與含硫組分物質的量分數的變化關系如圖所示。

請寫出a點時n(HSO3-)∶n(H2SO3)=______,b點時溶液pH=7,則n(NH4+)∶n(HSO3-)=______;
(3)催化氧化法去除NO,一定條件下,用NH3消除NO污染,其反應原理為:4NH3+6NO![]() 5N2+ 6H2O。不同溫度條件下,n(NH3):n(NO)的物質的量之比分別為4∶l、3∶l、1∶3時,得到NO脫除率曲線如圖所示:
5N2+ 6H2O。不同溫度條件下,n(NH3):n(NO)的物質的量之比分別為4∶l、3∶l、1∶3時,得到NO脫除率曲線如圖所示:

①請寫出N2的電子式________;
② 曲線c對應NH3與NO的物質的量之比是______;
③曲線a中NO的起始濃度為6×10-4mg·m-3,從A點到B點經過0.8s,該時間段內NO的脫除速率為___________mg·m-3·s-1;
(4)間接電化學法可除NO。其原理如上右圖所示,寫出電解池陰極的電極反應式(陰極室溶液呈酸性)__________________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com