



科目:高中化學 來源: 題型:
| A、加入碳酸鈉溶液產生白色沉淀,再加鹽酸白色沉淀消失,一定有Ba2+ |
| B、加入氯化鋇溶液有白色沉淀產生,再加鹽酸,沉淀不消失,一定有SO42- |
| C、加入硝酸銀溶液有白色沉淀產生,一定有Cl- |
| D、加入氫氧化鈉溶液并加熱,產生的氣體能使濕潤紅色石蕊試紙變藍,一定有NH4+ |
查看答案和解析>>
科目:高中化學 來源: 題型:
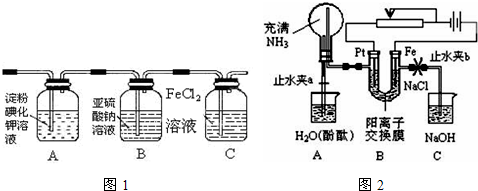
| 實驗步驟 | 預期現象和結論 |
| 步驟1:取適量洗氣瓶B中溶液于試管A中,滴加 | 若產生白色沉淀,則洗氣瓶B溶液中存在SO42-. |
| 步驟2:另取適量洗氣瓶B中溶液于試管B中,滴加 | 產生白色沉淀. |
| 步驟3:取步驟2后試管B中的上層清液于試管C中 滴加 |
查看答案和解析>>
科目:高中化學 來源: 題型:
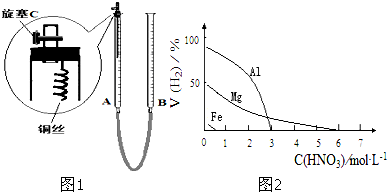
| 序號 | 濃硝酸與水的體積比 | 實驗現象 |
| Ⅰ | 1:1 | 反應速率快,溶液很快變成藍色,銅絲表面有大量氣泡冒出,氣體呈紅棕色 |
| Ⅱ | 1:3 | 反應速率較快,溶液變成藍色,銅絲表面有大量氣泡冒出,氣體無色 |
| Ⅲ | 1:5 | 反應速率慢,微熱后速率加快,溶液變成藍色,銅絲表面有氣泡冒出,氣體無色 |
| 影響因素 | 實驗步驟 | 實驗結論 |
| 金屬種類 | 兩只燒瓶中各放入5g顆粒大小大致相同的Fe粉、Mg粉,分別加入 | 在該濃度的稀HNO3中,Mg能反應, |
| HNO3濃度 | 兩只燒瓶中各放入5g顆粒大小大致相同的Mg粉,分別加入 | 硝酸濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
A、該反應的化學平衡常數表達式是K=
| ||
| B、此時,B的平衡轉化率是35% | ||
| C、增大該體系的壓強,平衡向右移動,化學平衡常數 | ||
| D、增加C,B的平衡轉化率不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、依據相對分子質量的數據,推測乙醇和丙烷沸點的相對高低 |
| B、依據溶解度數據,選擇用萃取的方法將粗溴提純 |
| C、依據沸點數據,判斷用分餾的方法從石油中獲取汽油和煤油等 |
| D、依據苯與氫氣加成反應的反應熱數據與其他烯烴的加成反應對比,研究苯化學鍵的特征 |
查看答案和解析>>
科目:高中化學 來源: 題型:
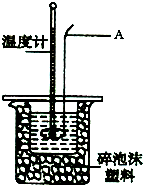 某實驗小組用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液進行中和熱的測定.
某實驗小組用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液進行中和熱的測定.| 實驗次數 | 起始溫度t1/℃ | 終止溫度t2/℃ | 溫度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.6 | 26.6 | 26.6 | 29.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化學 來源: 題型:
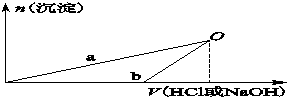 某同學研究鋁及其化合物的性質時設計了如下兩個實驗方案.
某同學研究鋁及其化合物的性質時設計了如下兩個實驗方案.| 100ml稀鹽酸 |
| NaOH溶液 |
| 100mlNaOH溶液 |
| 稀鹽酸 |
| A、X溶液溶質為AlCl3,Y溶液溶質為NaAlO2 |
| B、b曲線表示的是向X溶液中加入NaOH溶液 |
| C、在O點時兩方案中所得溶液濃度相等 |
| D、a、b曲線表示的反應都是氧化還原反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com