
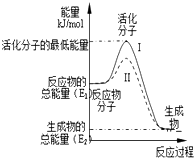
 (1)已知:
(1)已知:分析 (1)①Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H1=-272.0kJ•mol-1;
②2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H2=-1675.7kJ•mol-1;
依據蓋斯定律計算②-①×3計算;
(2)①依據圖象分析反應物的能量大于生成物的能量,反應放熱;在化學反應中,只有極少數能量比平均能量高得多的反應物分子發生碰撞時才能發生化學反應,反應需要能量;反應的焓變=生成物的能量-反應物的能量;
②反應的活化能是使普通分子變成活化分子所需提供的最低限度的能量,依據圖象能量關系可知,逆反應的活化能=正反應的活化能+反應的焓變;
③對于同一反應,圖中虛線( II)與實線( I)相比,活化能大大降低,活化分子的百分數增多,反應速率加快,說明反應的活化能降低焓變不變,平衡不動,結合影響所以速率的元素分析判斷.
解答 解:(1)①Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H1=-272.0kJ•mol-1;
②2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H2=-1675.7kJ•mol-1;
依據蓋斯定律計算②-①×3得到:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7KJ/mol;
故答案為:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7KJ/mol;
(2)①依據圖象分析反應物的能量大于生成物的能量,反應放熱;在化學反應中,只有極少數能量比平均能量高得多的反應物分子發生碰撞時才能發生化學反應,反應需要能量;反應的焓變=生成物的能量-反應物的能量,即△H=(E2-E1)kJ•mol-1,
故答案為:放熱;(E2-E1)kJ•mol-1;
(2)反應的活化能是使普通分子變成活化分子所需提供的最低限度的能量,依據圖象能量關系可知,逆反應的活化能=正反應的活化能+反應的焓變;H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,該反應的活化能為167.2kJ•mol-1,則其逆反應的活化能=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol,
故答案為:409.0KJ/mol;
(3)對于同一反應,圖中虛線( II)與實線( I)相比,活化能大大降低,活化分子的百分數增多,反應速率加快,說明反應的活化能降低焓變不變,平衡不動,化學反應速率影響因素中,催化劑有此作用,所以最有可能使用了催化劑,故答案為:使用了催化劑.
點評 本題考查了熱化學方程式書寫和蓋斯定律計算以及化學反應的能量變化與反應的焓變關系的分析判斷,反應活化能的判斷計算,圖象的綜合應用,題目難度不大,讀懂圖象,焓變和活化能計算方法的理解是解題的關鍵.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 保存濃硝酸時,通常用棕色瓶并放在陰涼處 | |
| B. | 用鋅與硫酸反應制取氫氣時,適當增大硫酸溶液的濃度 | |
| C. | 合成氨的反應中,選擇“鐵觸媒”作催化劑 | |
| D. | 在試管中進行鋁和氫氧化鈉溶液反應時,稍微加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 金剛石比石墨穩定 | B. | 1mol石墨比1mol金剛石的總能量低 | ||
| C. | 石墨比金剛石穩定 | D. | 1mol石墨比1mol金剛石的總能量高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
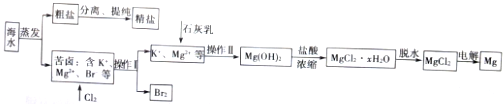
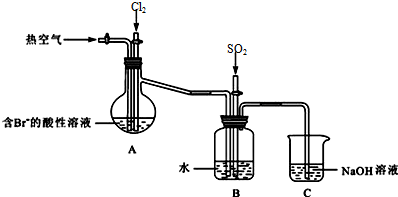
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 反應aA(g)+bB(g)$\stackrel{催化劑}{?}$cC(g)(△H<0)在等容條件下進行.改變其他反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質濃度隨時間變化的曲線如圖所示:比較第Ⅱ階段反應溫度(T2)和第Ⅲ階段反應溫度(T3)的高低:T2__T3( )
反應aA(g)+bB(g)$\stackrel{催化劑}{?}$cC(g)(△H<0)在等容條件下進行.改變其他反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質濃度隨時間變化的曲線如圖所示:比較第Ⅱ階段反應溫度(T2)和第Ⅲ階段反應溫度(T3)的高低:T2__T3( )| A. | > | B. | = | ||
| C. | < | D. | 條件不足,無法判斷 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com