
【題目】有機物的天然提取和人工合成往往得到的是混合物,假設給你一種這樣的有機混合物讓你研究,一般要采取的幾個步驟是
A. 確定化學式→確定實驗式→確定結構式→分離、提純
B. 分離、提純→確定化學式→確定實驗式→確定結構式
C. 分離、提純→確定結構式→確定實驗式→確定化學式
D. 分離、提純→確定實驗式→確定分子式→確定結構式
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化學 來源: 題型:
【題目】某無色溶液能與鋁作用生成H2,則溶液中一定可以大量共存的離子組是
A. Cl-、Ba2+、Mg2+、ClO- B. Cl-、SO42-、Cu2+、Mg2+
C. Cl-、SO42-、K+、Na+ D. HCO3-、NO3-、Na+、Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】列關于氯氣的實驗裝置能達到實驗目的的是

①可用于氯氣的收集 ②若氣球干癟,證明Cl2可與NaOH反應 ③可證明氯氣具有漂白性 ④可用于實驗室中氯氣的尾氣吸收
A. ①② B. ①③ C. ②③ D. ①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四川攀枝花蘊藏豐富的釩、鈦、鐵資源。用鈦鐵礦渣(主要成分為TiO2、FeO、Fe2O3、Ti的最高化合價為+4)作原料,生產白色顏料二氧化鈦的主要步驟如下:
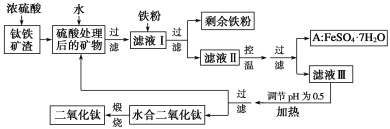
請回答下列問題:
(1)硫酸與二氧化鈦反應的化學方程式是______________________________________。
(2)向濾液Ⅰ中加入鐵粉,發(fā)生反應的離子方程式為____________、_______________。
(3)在實際生產過程中,向沸水中加入濾液Ⅲ,使混合液pH達0.5,鈦鹽開始水解。書寫水解的離子方程式:_________。
(4)水解過程中不斷通入高溫水蒸氣,維持溶液沸騰一段時間,鈦鹽充分水解析出水合二氧化鈦沉淀。請用所學化學平衡原理分析通入高溫水蒸氣的作用:_____________。
(5)過濾分離出水合二氧化鈦沉淀后,將濾液返回的主要目的是充分利用濾液中的鈦鹽、______(填化學式),減少廢物排放。
(6)A可用于生產紅色顏料(Fe2O3),其實驗方法是:
a.5.56a kg A(摩爾質量為278g·mol-1)溶于水中,加入適量氫氧化鉀溶液恰好完全反應,鼓入足量空氣攪拌,產生紅褐色膠體;
b.再向紅褐色膠體中加入33.36b kg A和1.12c kg鐵粉,鼓入足量空氣攪拌,反應完成后,有大量Fe2O3附著在膠體粒子上以沉淀形式析出;
c.過濾后,沉淀經高溫灼燒得紅色顏料。
若所得濾液中溶質只有硫酸鉀和硫酸鐵,則理論上可生產紅色顏料__________ kg。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.甲醇是一種重要化工原料,又是一種可再生能源,具有開發(fā)和應用的廣闊前景。
(1)利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下合成甲醇,發(fā)生的主反應如下:①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列問題:
CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列問題:
化學鍵 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
①已知反應①中的相關的化學鍵鍵能(“C![]() O”表示CO的化學鍵)數(shù)據見表:由此計算△H1=________ kJ·mol-1
O”表示CO的化學鍵)數(shù)據見表:由此計算△H1=________ kJ·mol-1
②請寫出CO2(g)和H2(g)反應生成CH3OH(g)和H2O(g)的熱化學方程式:____________________該反應的平衡常數(shù)K3=_______________ 。 (反應①和反應②對應的平衡常數(shù)為K1和K2)
(2)由甲醇、氧氣和NaOH溶液構成的新型手機電池,可使手機連續(xù)使用一個月才充一次電。該電池負極的電極反應式為________________。
Ⅱ.在2L密閉容器中,800℃時反應2NO(g)+O2 (g)![]() 2NO2 (g)體系中,n(NO)隨時間的變化如表:
2NO2 (g)體系中,n(NO)隨時間的變化如表:
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(3)如圖所示表示NO2變化曲線的是____,用O2表示從0~2 s內該反應的平均速率v=_____。

(4)能說明該反應已達到平衡狀態(tài)的是_______(填序號)。
a.v(NO2) =2V(O2) b.容器內壓強保持不變
c.體系顏色不再改變 d.容器內密度保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將SO2分別通入下列4種溶液中,有關說法正確的是

A. 試管a中實驗可以證明SO2具有漂白性
B. 試管b中溶液褪色,說明SO2具有強氧化性
C. 試管c中能產生白色沉淀,該沉淀的成分為BaSO3
D. 試管d中能產生白色沉淀,該沉淀完全溶于稀鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二甲醚是一種重要的清潔燃料,也可替代氟利昂作制冷劑等,對臭氧層無破壞作用。工業(yè)上可利用煤與水蒸氣反應得到煤的氣化產物(水煤氣),再合成二甲醚。
請回答下列問題:
(1)煤的氣化的主要化學反應方程式為:_______________________________________。
(2)利用水煤氣合成二甲醚的三步反應如下:
① 2H2(g) + CO(g) ![]() CH3OH(g) ΔH = -90.8 kJ·mol-1
CH3OH(g) ΔH = -90.8 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g) ΔH= -41.3 kJ·mol-1
總反應:3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2 (g)的ΔH=_____________。
CH3OCH3(g) + CO2 (g)的ΔH=_____________。
(3)已知反應②2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)某溫度下的平衡常數(shù)為400 。此溫度下,在密閉恒容容器中加入CH3OH ,反應到某時刻測得各組分濃度如下:
CH3OCH3(g) + H2O(g)某溫度下的平衡常數(shù)為400 。此溫度下,在密閉恒容容器中加入CH3OH ,反應到某時刻測得各組分濃度如下:
物質 | CH3OH | CH3OCH3 | H2O |
濃度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比較此時正、逆反應速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,經10 min反應達到平衡,此時c(CH3OH) = ______ ;該時間內反應速率v(CH3OH) = _______________________________。
③下列措施中能說明反應達到平衡狀態(tài)的是___________
A.體系壓強保持不變
B.混合氣體的密度保持不變
C.CH3OH與H2O的濃度之比為1∶2
D.單位時間內,消耗2mol CH3OH的同時消耗1molH2O
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com